資料2:臨床研究中核病院業務報告内容確認表 (137 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
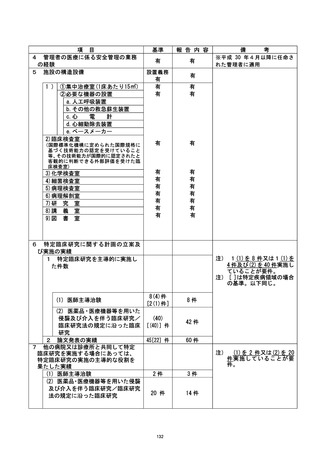
不適正事評に関する対応状況 : |
| 本研究では、論理チェックを用いた2回/年の中央モニタリングで研究実施計画書から
の「逸脱の可能性例」を確認していた。 については2017年12月11日に発生しており、当 |
該モニタリングにより2018年11月29日に「逸脱の可能性例」として抽出されていた。 ②に
| ついては、1例目の逸脱が2018年1月25日に発生し、2019年3月27日にモニタリングで「濁
脱の可能性例」として抽出、2例目の人逸脱が2018年9月27日に発生し、 2020年3月24日に「和逸 |
| 脱の可能性便」として抽出、3例目が2018年12月28日に逸脱が発生し、2020年9月30日に「作|
脱の可能性例」として抽出されていた。③については、2019年3月19日、2019年11月26日
にそれぞれ規定日外での投薬が行われており、2020年3月24日に「逸脱の可能性例」とし
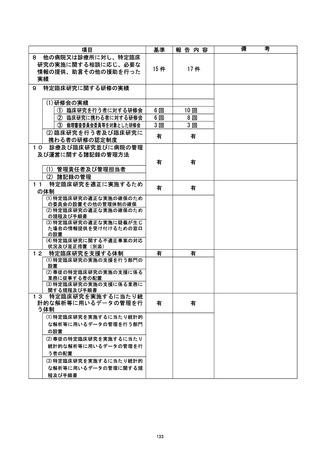
て抽出されていた。 中央モニタリングで見いだされた「逸脱の可能性例」に関しては、3
回/年実施の本研究参加医療機関の定例会議において試験事務局より注意嘆起を行って
きており、各案件は「和逸脱の可能性例」として抽出された後の当該研究会内で速やかに周
知が行われていた。 各事案はその時点で重大な不適合事案と判断されず、そのため委上員会
への報告も行われなかったが、 今般、 登録全症例の研究観察期間が終了し、 データクリー
ニングが行われた際、 被験薬の投与量・投与時期の違反に関しては、 重大な不適合として
報告する必要があると判断された。本来であれば重大な不適合に関する報告は発生後束
やかに行われることが計画書上で規定されていたにも関わらず報告ができていなかった
ため、 ④「報告の遅延」 についても重大な不適合に該当すると考えられ、同時に報告が行
われた。 被験薬の投与量・投与時期の違反という重大な不適合が正確に認識され、 適切に
報告されなかったのは、研究責任医師が研究対象者の安全性に問題はないと判断したた
めであったが、研究計画書における被験薬投与に関する規定は、 研究対象者の安全性確保
や主要評価項目の評価のために重要な規定であり、個々の発生例の影響の大小に関係な
く「重大な不適合」として認識すべきであった。
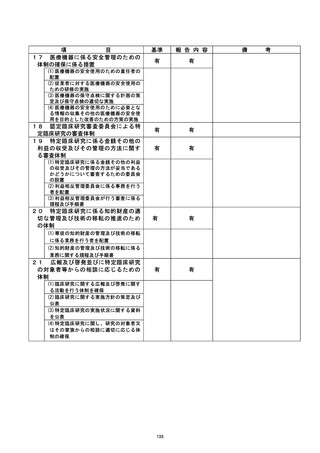
是正措置 :
被験薬投与量・投与時期の違反に対しては、 中央モニタリングで逸脱の可能性例として
把握された時点で、本研究の全参加医師を対象とした定例研究会で注意喚起が行われて
おり、 研究を安全に進める体制はすでに整備されていたものと考えられた。 また、 投与量
と投与時期の間違いについては研究分担医師の研究計画書の理解が不十分であったこと
が原因と考えられたため、 当該研究会にて計画書の規定の確認と、被験薬の投与手順のダ
ブルチェックと体重変化量を計算できるツールの提供が行われていた。一方、 重大な不適
合の報告遅延については、本研究では本報告があった時点ですでに研究が終了する時期
となっていたが、 今後の研究実施に向け、 不適合の定義とその発生時の対応について、法
律と研究計画書の規定について研究責任医師による確認が行われた。
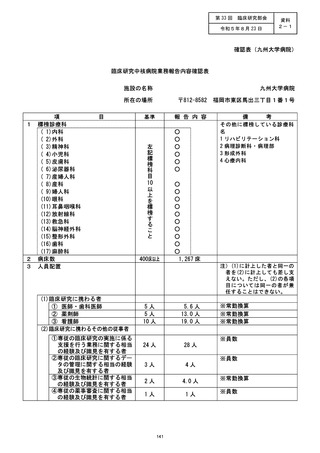
登録D等 | 請洒還記議 治験・臨床研究名 |
不適正事案の概要 :
亀多池設共同研究 (岡山大学病院主管)
僅不適正事康発生施設 : 岡山大学病院
不適正事案の内容 : 同意書の説明者 (研究責任医師又は研究分担医師名) 署名欄において、
あらかじめ説明者氏名を記名して作成し、これに説明者が署名を行うことなく研究対象
者から同意を取得した (なお、研究対象者の署名は直筆でいただいている)
137