よむ、つかう、まなぶ。
資 料4-2 令和4年度第1回安全技術調査会の審議結果について (76 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
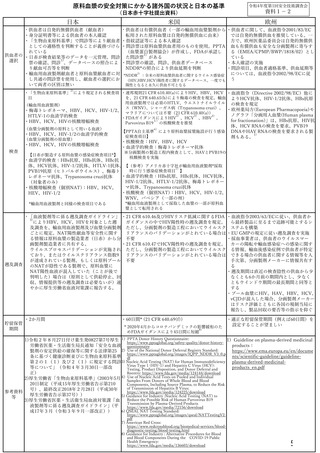
第8条に基づき、「医療関係者」は血液製剤の適正な使用に努めるとともに、
第8条に基づき、「医療関係者」は血液製剤の適正な使用に努めるとともに、
血液製剤の安全性に関する情報の収集及び提供に努めなければならない。
血液製剤の安全性に関する情報の収集及び提供に努めなければならない。
また、「医療関係者」は、
_○
同法第9条に基づく「血液製剤の安全性の向上及び安定供給の確保を図る
○
同法第9条に基づく「血液製剤の安全性の向上及び安定供給の確保を図るた
ための基本的な方針」(平成 25 年厚生労働省告示第 247 号)第六及び第七に
めの基本的な方針」(平成 25 年厚生労働省告示第 247 号)第六及び第七に則
則り、特定生物由来製品を使用する際には、原材料に由来する感染のリスク
り、特定生物由来製品を使用する際には、原材料に由来する感染のリスク等に
等について、特段の注意を払う必要があることを十分認識する必要がある。
ついて、特段の注意を払う必要があることを十分認識する必要がある。
_○
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭
○
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和
和 35 年法律第 145 号。以下「医薬品医療機器等法」という。)第 68 条の 21
35 年法律第 145 号。以下「医薬品医療機器等法」という。)第 68 条の 21 に基
に基づき、血液製剤の有効性及び安全性その他当該製品の適正な使用のため
づき、血液製剤の有効性及び安全性その他当該製品の適正な使用のために必要
に必要な事項について、患者又はその家族に対し、適切かつ十分な説明を行
な事項について、患者又はその家族に対し、適切かつ十分な説明を行い、その
い、その理解を得るよう努めなければならない。
理解を得るよう努めなければならない。
_○
2
また、「医療関係者」は、
医薬品医療機器等法第 68 条の 22 第3項及び第4項に基づき、特定生物由
○
医薬品医療機器等法第 68 条の 22 第3項及び第4項に基づき、特定生物由来
来製品の使用の対象者の氏名、住所その他必要な事項について記録を作成し、
製品の使用の対象者の氏名、住所その他必要な事項について記録を作成し、保
保存(20 年)することが必要である。
存(20 年)することが必要である。
輸血前後の感染症検査の実施(輸血用血液製剤について)
2
輸血前後の感染症検査の実施
医師が感染リスクを考慮し、感染が疑われる場合などには、受血者(患者)
医師が感染リスクを考慮し、感染が疑われる場合などには、受血者(患者)
に対して輸血用血液製剤投与前後の感染症検査を「輸血療法の実施に関する指
に対して輸血用血液製剤投与前後の感染症検査を「輸血療法の実施に関する指
針」(改訂版)3)(以下「指針」という。)の VII の1.2)(2)ⅱ及びⅲの規
針」(改訂版)3)(以下「指針」という。)の VII の1.2)(2)ⅱ及びⅲの規
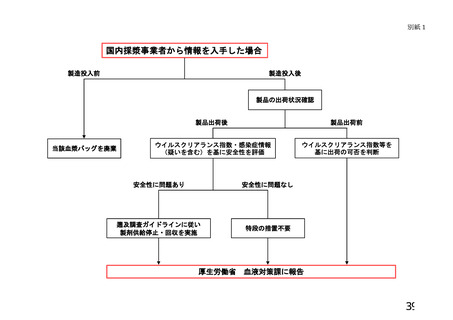
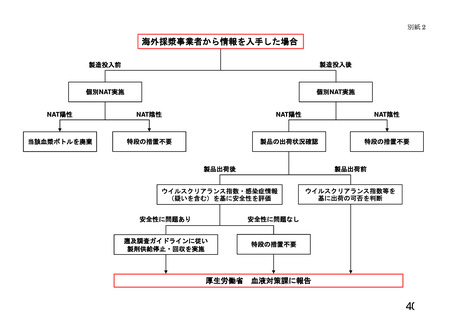
定(別紙1)に基づいて行う※注3、4。医療機関は、患者検体の保存を指針Ⅵの
定(別紙1)に基づいて行う※注1、2。医療機関は、患者検体の保存を指針Ⅵの
5
74
第8条に基づき、「医療関係者」は血液製剤の適正な使用に努めるとともに、
血液製剤の安全性に関する情報の収集及び提供に努めなければならない。
血液製剤の安全性に関する情報の収集及び提供に努めなければならない。
また、「医療関係者」は、
_○
同法第9条に基づく「血液製剤の安全性の向上及び安定供給の確保を図る
○
同法第9条に基づく「血液製剤の安全性の向上及び安定供給の確保を図るた
ための基本的な方針」(平成 25 年厚生労働省告示第 247 号)第六及び第七に
めの基本的な方針」(平成 25 年厚生労働省告示第 247 号)第六及び第七に則
則り、特定生物由来製品を使用する際には、原材料に由来する感染のリスク
り、特定生物由来製品を使用する際には、原材料に由来する感染のリスク等に
等について、特段の注意を払う必要があることを十分認識する必要がある。
ついて、特段の注意を払う必要があることを十分認識する必要がある。
_○
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭
○
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和
和 35 年法律第 145 号。以下「医薬品医療機器等法」という。)第 68 条の 21
35 年法律第 145 号。以下「医薬品医療機器等法」という。)第 68 条の 21 に基
に基づき、血液製剤の有効性及び安全性その他当該製品の適正な使用のため
づき、血液製剤の有効性及び安全性その他当該製品の適正な使用のために必要
に必要な事項について、患者又はその家族に対し、適切かつ十分な説明を行
な事項について、患者又はその家族に対し、適切かつ十分な説明を行い、その
い、その理解を得るよう努めなければならない。
理解を得るよう努めなければならない。
_○
2
また、「医療関係者」は、
医薬品医療機器等法第 68 条の 22 第3項及び第4項に基づき、特定生物由
○
医薬品医療機器等法第 68 条の 22 第3項及び第4項に基づき、特定生物由来
来製品の使用の対象者の氏名、住所その他必要な事項について記録を作成し、
製品の使用の対象者の氏名、住所その他必要な事項について記録を作成し、保
保存(20 年)することが必要である。
存(20 年)することが必要である。
輸血前後の感染症検査の実施(輸血用血液製剤について)
2
輸血前後の感染症検査の実施
医師が感染リスクを考慮し、感染が疑われる場合などには、受血者(患者)
医師が感染リスクを考慮し、感染が疑われる場合などには、受血者(患者)
に対して輸血用血液製剤投与前後の感染症検査を「輸血療法の実施に関する指
に対して輸血用血液製剤投与前後の感染症検査を「輸血療法の実施に関する指
針」(改訂版)3)(以下「指針」という。)の VII の1.2)(2)ⅱ及びⅲの規
針」(改訂版)3)(以下「指針」という。)の VII の1.2)(2)ⅱ及びⅲの規
定(別紙1)に基づいて行う※注3、4。医療機関は、患者検体の保存を指針Ⅵの
定(別紙1)に基づいて行う※注1、2。医療機関は、患者検体の保存を指針Ⅵの
5
74