よむ、つかう、まなぶ。
資 料4-2 令和4年度第1回安全技術調査会の審議結果について (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
に、その後も患者の健康状態について、少なくとも輸血(又は投与)後6
か月間、患者の病態等必要に応じて引き続き、注意深くフォローアップす
ることが望まれる。
② 患者が陽転の場合
対象製剤を輸血(又は投与)された患者に対し、検査結果及び対象製剤
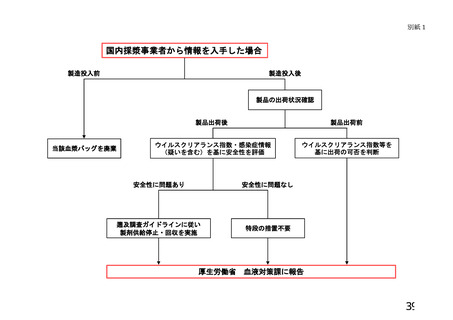
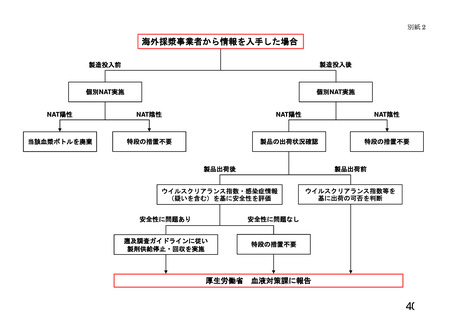
のリスク評価(別紙2)の結果を説明するとともに、必要に応じ適切な医
療を提供する※注6。対応は、5(1)に準ずる。
(イ) 輸血用血液製剤投与前後の感染症検査が指針に基づいて行われていない場合
(血漿分画製剤の投与前後に、指針に準ずる感染症検査を特段実施していない
場合を含む)
受血者(患者)に対し、対象製剤が投与された事実及び当該対象製剤のリス
ク評価(別紙2)の結果を説明するとともに、輸血用血液製剤の場合は指針に
基づき、受血者(患者)の保管血液に係る輸血前後の感染症検査を速やかに実
施し、その検査結果を説明する。この際、コンタミネーションのないようにデ
ィスポーザブルのピペットを使用するなどの対応が望まれる。なお、検査後の
対応は上記(ア)に準じて行う。
なお、血漿分画製剤の使用による感染が疑われる場合であって患者保管検体
がある場合は、当該医療機関において検査を実施するか、又はプライバシーを
配慮した上で、当該検体を製造販売業者等に提供するよう努めるものとする。
6 日本赤十字社の対応
(1) 医療機関で輸血用血液製剤による感染が疑われた場合(医療機関発)
日本赤十字社は、医療機関から情報提供(報告)があった場合、医薬品医療機器
等法第 68 条の 10 第1項に基づき、医薬品医療機器総合機構に副作用感染症報告
(速報)を届け出るとともに、同法第 68 条の9第1項に基づき、速やかに以下の
ア~エを行う。
ア 供給停止又は回収及び医療機関等への情報提供
供給前であれば、感染拡大防止のため、当該輸血用血液製剤と同一の供血者に
由来※注5する輸血用血液製剤等について、医療機関又は血漿分画製剤の製造販売
業者への供給を直ちに停止する※注7。
また、供給後であれば、当該輸血用血液製剤を供給した医療機関に対して、直
ちに連絡を行い、別紙2に示す情報提供を行う。なお、日本赤十字社保管の当該
輸血用血液製剤に係る保管検体が全て個別 NAT 陰性の場合にも、医療機関への情
7
12
か月間、患者の病態等必要に応じて引き続き、注意深くフォローアップす
ることが望まれる。
② 患者が陽転の場合
対象製剤を輸血(又は投与)された患者に対し、検査結果及び対象製剤
のリスク評価(別紙2)の結果を説明するとともに、必要に応じ適切な医
療を提供する※注6。対応は、5(1)に準ずる。
(イ) 輸血用血液製剤投与前後の感染症検査が指針に基づいて行われていない場合
(血漿分画製剤の投与前後に、指針に準ずる感染症検査を特段実施していない
場合を含む)
受血者(患者)に対し、対象製剤が投与された事実及び当該対象製剤のリス
ク評価(別紙2)の結果を説明するとともに、輸血用血液製剤の場合は指針に
基づき、受血者(患者)の保管血液に係る輸血前後の感染症検査を速やかに実
施し、その検査結果を説明する。この際、コンタミネーションのないようにデ
ィスポーザブルのピペットを使用するなどの対応が望まれる。なお、検査後の
対応は上記(ア)に準じて行う。
なお、血漿分画製剤の使用による感染が疑われる場合であって患者保管検体
がある場合は、当該医療機関において検査を実施するか、又はプライバシーを
配慮した上で、当該検体を製造販売業者等に提供するよう努めるものとする。
6 日本赤十字社の対応
(1) 医療機関で輸血用血液製剤による感染が疑われた場合(医療機関発)
日本赤十字社は、医療機関から情報提供(報告)があった場合、医薬品医療機器
等法第 68 条の 10 第1項に基づき、医薬品医療機器総合機構に副作用感染症報告
(速報)を届け出るとともに、同法第 68 条の9第1項に基づき、速やかに以下の
ア~エを行う。
ア 供給停止又は回収及び医療機関等への情報提供
供給前であれば、感染拡大防止のため、当該輸血用血液製剤と同一の供血者に
由来※注5する輸血用血液製剤等について、医療機関又は血漿分画製剤の製造販売
業者への供給を直ちに停止する※注7。
また、供給後であれば、当該輸血用血液製剤を供給した医療機関に対して、直
ちに連絡を行い、別紙2に示す情報提供を行う。なお、日本赤十字社保管の当該
輸血用血液製剤に係る保管検体が全て個別 NAT 陰性の場合にも、医療機関への情
7
12