よむ、つかう、まなぶ。
資 料4-2 令和4年度第1回安全技術調査会の審議結果について (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
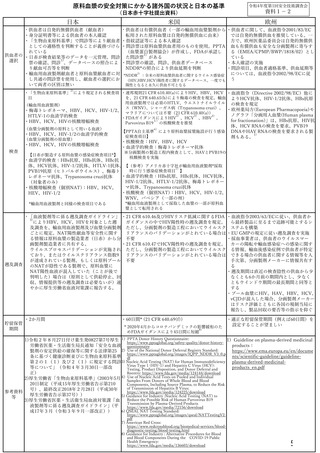
ら製造された血液製剤の情報、当該製剤が投与された患者の感染に係る情報等を収集
し、それを科学的に分析・評価することである。
3 調査対象範囲
(1) 病原体
HBV、HCV 及び HIV とする。
なお、梅毒トレポネーマについては、(1)世界的にも 30~40 年以上も前に行わ
れた院内採血に伴う感染報告のみであることから、先進各国でも対象としていな
いこと、(2)血液の低温保管中で死滅するという報告があること、(3)日本赤十字
社が血液製剤を供給する体制がとられてから報告がないこと等から、対象範囲か
ら除外することとした。
その他の病原体については、遡及調査の必要性が確立しているとは言えず、今
後の実情にあわせて検討を加えることとする。
(2) 血液製剤等
輸血用血液製剤及び原料血漿(以下「輸血用血液製剤等」という。)並びに血
漿分画製剤(遺伝子組換え製剤を含む。以下同じ。)とし、院内採血の場合は除
く。
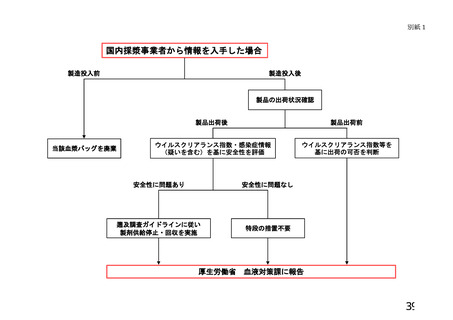
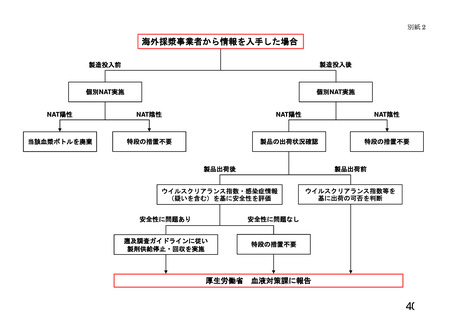
4 遡及調査の発端となる情報
遡及調査の発端として、以下の2通りの情報が考えられる。
(1) 供(献)血者からの情報
供血者の検査結果及び同一者の過去の供血歴から、血液製剤等への混入の可能
性が認められた場合(以下「供血者発」という。)
(2) 医療機関からの情報
医療機関からの副作用感染症報告により、使用した血液製剤等で受血者(患
者)の病原体感染が疑われた場合(以下「医療機関発」という。)
5 医療機関の対応
[対応の前提]
4
9
し、それを科学的に分析・評価することである。
3 調査対象範囲
(1) 病原体
HBV、HCV 及び HIV とする。
なお、梅毒トレポネーマについては、(1)世界的にも 30~40 年以上も前に行わ
れた院内採血に伴う感染報告のみであることから、先進各国でも対象としていな
いこと、(2)血液の低温保管中で死滅するという報告があること、(3)日本赤十字
社が血液製剤を供給する体制がとられてから報告がないこと等から、対象範囲か
ら除外することとした。
その他の病原体については、遡及調査の必要性が確立しているとは言えず、今
後の実情にあわせて検討を加えることとする。
(2) 血液製剤等
輸血用血液製剤及び原料血漿(以下「輸血用血液製剤等」という。)並びに血
漿分画製剤(遺伝子組換え製剤を含む。以下同じ。)とし、院内採血の場合は除
く。
4 遡及調査の発端となる情報
遡及調査の発端として、以下の2通りの情報が考えられる。
(1) 供(献)血者からの情報
供血者の検査結果及び同一者の過去の供血歴から、血液製剤等への混入の可能
性が認められた場合(以下「供血者発」という。)
(2) 医療機関からの情報
医療機関からの副作用感染症報告により、使用した血液製剤等で受血者(患
者)の病原体感染が疑われた場合(以下「医療機関発」という。)
5 医療機関の対応
[対応の前提]
4
9