よむ、つかう、まなぶ。
資 料4-2 令和4年度第1回安全技術調査会の審議結果について (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
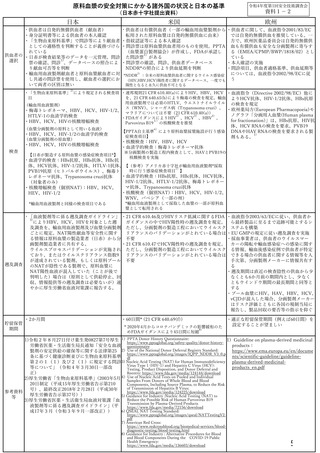
原料血漿の安全対策にかかる諸外国の状況と日本の基準
令和4年度第1回安全技術調査会
(日本赤十字社提出資料)
資料1-2
日本
・供血者は自発的無償供血者(献血者)
米国
欧州
・供血者は有償供血者(一部の輸血用血漿製剤から ・供血者に関して、血液指令2001/83/EC
・身分証明書等による供血者の本人確認
転用された原料血漿は自発的無償供血に由来)
では自発的無償供血を推奨している。一
・「生物由来原料基準」で問診等により献血者 ・指紋認証等による本人確認
方で、欧州医薬品委員会は自発的無償供
としての適格性を判断することが義務づけら ・問診票は原料血漿供血者用のものを使用。PPTA 血も有償供血も安全な分画製剤に寄与す
れている
(血漿蛋白製剤協会)が作成し、FDAが承認し
る(EMEA/CPMP/BWP/1818/02)とし
供血者の ・日赤が検査結果等のデータを一元管理。問診 た問診票1)がある
ている
1)
選択
票の確認、問診 、データベースの照合によ ・問診票の確認、問診、供血者データベース
・本人確認の実施
り献血可否等を判断
・問診項目、供血者適格基準、供血延期等
NDDR*の照合により供血延期を判断
2)
・輸血用血液製剤献血者と原料血漿献血者に対 *NDDR :全米の原料血漿供血者に関するウイルス感染症 については、血液指令2002/98/ECに従
し共通の問診票を使用し、献血者の選択にお (HIV,HBV,HCV)陽性者に関するデータベース。一度でも う
いて両者の区別は無い
陽性となると永久に供血不可となる
2)
・「生物由来原料基準」 により規定される検査項 ・連邦規則21 CFR 610.40(a)によりHIV、HBV、HCV ・血液指令(Directive 2002/98/EC)他に
目
を、21 CFR 640.65(b)により梅毒の検査を規定。輸血 よりHCV抗体、HIV-1/2抗体、HBs抗原
用血液製剤では必須のHTLV、ウエストナイルウイル の検査を規定
(輸血用血液製剤)
ス(WNV)、シャーガス病(Trypanosoma cruzi)、 ・欧州薬局方(European Pharmacopoeia)モ
・梅毒トレポネーマ、HBV、HCV、HIV-1/2、
マラリアについては不要(21 CFR 610.40(a))
ノグラフ「分画用人血漿(Human plasma
3)
3)
4)
HTLV-1の血清学的検査
・FDAガイダンスによりHIV 、HCV 、HBV 、
5)
for fractionation)」は、HBs抗原、HIV抗
・HBV、HCV、HIVの核酸増幅検査
Parvovirus B19 の核酸検査を推奨
体、HCV RNAの検査を要求。PVB19
6)
(血漿分画製剤の原料として用いる血液)
【PPTA自主基準 により原料血漿採漿施設が行う感染 DNAやHAV RNAの検査を要求される製
1)
・HBV、HCV、HIV-1/2の血清学的検査
症検査項目】
剤もある。
(血漿分画製剤の原血漿)
・HBV、HCV、HIVの核酸増幅検査
検査
【日赤が製造する原料血漿の感染症検査項目*】
・血清学的検査:HBs抗原、HBs抗体、HBc抗
・核酸検査:HIV、HBV、HCV
・血清学的検査:梅毒トレポネーマ抗体
※分画製剤の製造工程内検査として、HAVとPVB19の
核酸検査を実施
体、HCV抗体、HIV-1/2抗体、HTLV-1抗体、 【(参考)アメリカ赤十字社が輸血用血液製剤*採取
7)
時に行う感染症検査項目 】
PVB19抗原(ヒトパルボウイルス)、梅毒ト
・血清学的検査:HBs抗原、HBc抗体、HCV抗体、
レポネーマ抗体、Trypanosoma cruzi抗体
HIV-1/2抗体、HTLV-1/2抗体、梅毒トレポネー
(対象者のみ)
マ抗体、Trypanosoma cruzi抗体
・核酸増幅検査(個別NAT):HBV、HCV、
・核酸検査(個別NAT):HBV、HCV、HIV-1/2、
HEV、HIV-1/2
WNV、バベシア(一部の州)
*輸血用血液製剤と同様の検査項目である
*輸血用血液製剤として採取した血漿の一部が原料血
漿として転用される
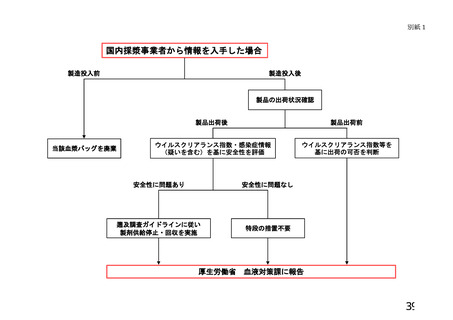
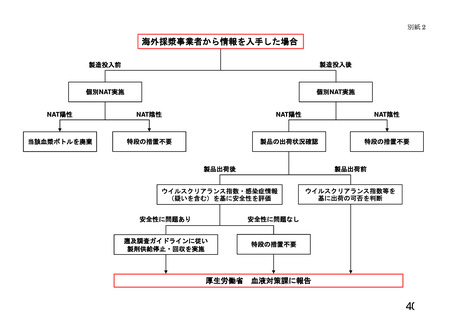
・「血液製剤等に係る遡及調査ガイドライン」 ・21 CFR 610.46及びHIVリスク低減に関するFDA ・血液指令2003/63/ECに従い、供血者か
3)
遡及調査
貯留保管
期間
によりHBV、HCV、HIVを対象とした遡
ガイダンスの中でHIV陽性時の遡及調査を規定。 ら最終製品に至るまで追跡可能とするシ
及調査を、輸血用血液製剤及び血漿分画製剤 ただし、分画製剤の製造工程においてウイルスク ステムを構築
ごとに規定。NAT陽性献血等安全性に関す
リアランスのバリデーションがとれている場合は ・EU GMPの規定に従い遡及調査を実施
る情報は原料血漿の製造業者(日赤)から分 不要
・採血事業者は、供血者のウイルスマー
画製剤製造業者に共有する。
・21 CFR 610.47でHCV陽性時の遡及調査を規定。 カーの陽転や輸血感染症への感染に関す
ウイルスプロセスバリデーションが実施され ただし、分画製剤の製造工程においてウイルスク る情報、輸血後感染症例で供血者が特定
ており、またはウイルスクリアランス指数9 リアランスのバリデーションがとれている場合は できる場合の供血者に関する情報等を入
が達成されている製剤、もしくは原料プール 不要
手次第、分画製剤メーカーに情報共有す
のNATが陰性である製剤で、原料血漿に
る
NAT陽性血液が混入していた(ことが後で
・遡及期間は直近の検査陰性の供血から少
判明した)場合は(原則として供給停止、回
なくとも6か月前の期間内とし、少なく
収、情報提供等の遡及調査は必要ないが)速
ともウインドウ期間の最長期間と同等と
やかに厚生労働省血液対策課に報告する。
する
・プール血漿にHIV、HAV、HBV、HCV、
vCJDが混入した場合、分画製剤メーカー
はリスク評価とともに各国の規制当局に
報告し、製品回収の要否等の指示を仰ぐ
・2か月間
・60日間* (21 CFR 640.69(f))
・適正な貯留保管期間(例えば60日間)を
設定することが望ましい
* 2020年4月からコロナパンデミックの影響緩和のた
8)
めFDAガイダンスにより45日間に短縮
1)Guideline on plasma-derived medicinal
1)令和2年8月27日付け薬生発0827第7号厚生 1)PPTA Donor History Questionnaire:
https://www.pptaglobal.org/safety-quality/donor-historyproducts:
労働省医薬・生活衛生局長通知「安全な血液 questionnaire
https://www.ema.europa.eu/en/docume
製剤の安定供給の確保等に関する法律第25 2)Use of the National Donor Deferral Registry Standard:
https://www.pptaglobal.org/images/IQPP_NDDR_V3_0.p
nts/scientific-guideline/guideline条に基づく健康診断並びに生物由来原料基準 df
第2の1(1)及び2(1)に規定する問診 3) Nucleic Acid Testing (NAT) for Human Immunodeficiency plasma-derived-medicinalVirus Type 1 (HIV-1) and Hepatitis C Virus (HCV):
products_en.pdf
等について」(令和4年3月30日一部改
Testing, Product Disposition, and Donor Deferral and
正)
Reentry: https://www.fda.gov/media/124144/download
of Nucleic Acid Tests on Pooled and Individual
2)厚生労働省「生物由来原料基準」(2003年5月 4)Use
Samples From Donors of Whole Blood and Blood
20日制定(平成15年厚生労働省告示第210
Components, Including Source Plasma, to Reduce the Risk
of Transmission of Hepatitis B Virus:
号)、最終改正2018年2月28日(平成30年
参考資料
https://www.fda.gov/media/124225/download
厚生労働省告示第37号))
5)
Guidance
for Industry :Nucleic Acid Testing (NAT) to
等
3)厚生労働省医薬・生活衛生局血液対策課「血 Reduce the Possible Risk of Human Parvovirus B19
Transmission by Plasma-Derived Products
液製剤等に係る遡及調査ガイドライン」(平
https://www.fda.gov/media/72156/download
6) QSEAL NAT Testing Standard:
成17年3月(令和3年9月一部改正))
https://www.pptaglobal.org/images/qseal/NATTestingV2.
pdf
7) American Red Cross:
https://www.redcrossblood.org/biomedical-services/blooddiagnostic-testing/blood-testing.html
8) Guidance for Industry : Alternative Procedures for Blood
and Blood Components During the COVID-19 Public
Health Emergency:
https://www.fda.gov/media/136603/download
5
令和4年度第1回安全技術調査会
(日本赤十字社提出資料)
資料1-2
日本
・供血者は自発的無償供血者(献血者)
米国
欧州
・供血者は有償供血者(一部の輸血用血漿製剤から ・供血者に関して、血液指令2001/83/EC
・身分証明書等による供血者の本人確認
転用された原料血漿は自発的無償供血に由来)
では自発的無償供血を推奨している。一
・「生物由来原料基準」で問診等により献血者 ・指紋認証等による本人確認
方で、欧州医薬品委員会は自発的無償供
としての適格性を判断することが義務づけら ・問診票は原料血漿供血者用のものを使用。PPTA 血も有償供血も安全な分画製剤に寄与す
れている
(血漿蛋白製剤協会)が作成し、FDAが承認し
る(EMEA/CPMP/BWP/1818/02)とし
供血者の ・日赤が検査結果等のデータを一元管理。問診 た問診票1)がある
ている
1)
選択
票の確認、問診 、データベースの照合によ ・問診票の確認、問診、供血者データベース
・本人確認の実施
り献血可否等を判断
・問診項目、供血者適格基準、供血延期等
NDDR*の照合により供血延期を判断
2)
・輸血用血液製剤献血者と原料血漿献血者に対 *NDDR :全米の原料血漿供血者に関するウイルス感染症 については、血液指令2002/98/ECに従
し共通の問診票を使用し、献血者の選択にお (HIV,HBV,HCV)陽性者に関するデータベース。一度でも う
いて両者の区別は無い
陽性となると永久に供血不可となる
2)
・「生物由来原料基準」 により規定される検査項 ・連邦規則21 CFR 610.40(a)によりHIV、HBV、HCV ・血液指令(Directive 2002/98/EC)他に
目
を、21 CFR 640.65(b)により梅毒の検査を規定。輸血 よりHCV抗体、HIV-1/2抗体、HBs抗原
用血液製剤では必須のHTLV、ウエストナイルウイル の検査を規定
(輸血用血液製剤)
ス(WNV)、シャーガス病(Trypanosoma cruzi)、 ・欧州薬局方(European Pharmacopoeia)モ
・梅毒トレポネーマ、HBV、HCV、HIV-1/2、
マラリアについては不要(21 CFR 610.40(a))
ノグラフ「分画用人血漿(Human plasma
3)
3)
4)
HTLV-1の血清学的検査
・FDAガイダンスによりHIV 、HCV 、HBV 、
5)
for fractionation)」は、HBs抗原、HIV抗
・HBV、HCV、HIVの核酸増幅検査
Parvovirus B19 の核酸検査を推奨
体、HCV RNAの検査を要求。PVB19
6)
(血漿分画製剤の原料として用いる血液)
【PPTA自主基準 により原料血漿採漿施設が行う感染 DNAやHAV RNAの検査を要求される製
1)
・HBV、HCV、HIV-1/2の血清学的検査
症検査項目】
剤もある。
(血漿分画製剤の原血漿)
・HBV、HCV、HIVの核酸増幅検査
検査
【日赤が製造する原料血漿の感染症検査項目*】
・血清学的検査:HBs抗原、HBs抗体、HBc抗
・核酸検査:HIV、HBV、HCV
・血清学的検査:梅毒トレポネーマ抗体
※分画製剤の製造工程内検査として、HAVとPVB19の
核酸検査を実施
体、HCV抗体、HIV-1/2抗体、HTLV-1抗体、 【(参考)アメリカ赤十字社が輸血用血液製剤*採取
7)
時に行う感染症検査項目 】
PVB19抗原(ヒトパルボウイルス)、梅毒ト
・血清学的検査:HBs抗原、HBc抗体、HCV抗体、
レポネーマ抗体、Trypanosoma cruzi抗体
HIV-1/2抗体、HTLV-1/2抗体、梅毒トレポネー
(対象者のみ)
マ抗体、Trypanosoma cruzi抗体
・核酸増幅検査(個別NAT):HBV、HCV、
・核酸検査(個別NAT):HBV、HCV、HIV-1/2、
HEV、HIV-1/2
WNV、バベシア(一部の州)
*輸血用血液製剤と同様の検査項目である
*輸血用血液製剤として採取した血漿の一部が原料血
漿として転用される
・「血液製剤等に係る遡及調査ガイドライン」 ・21 CFR 610.46及びHIVリスク低減に関するFDA ・血液指令2003/63/ECに従い、供血者か
3)
遡及調査
貯留保管
期間
によりHBV、HCV、HIVを対象とした遡
ガイダンスの中でHIV陽性時の遡及調査を規定。 ら最終製品に至るまで追跡可能とするシ
及調査を、輸血用血液製剤及び血漿分画製剤 ただし、分画製剤の製造工程においてウイルスク ステムを構築
ごとに規定。NAT陽性献血等安全性に関す
リアランスのバリデーションがとれている場合は ・EU GMPの規定に従い遡及調査を実施
る情報は原料血漿の製造業者(日赤)から分 不要
・採血事業者は、供血者のウイルスマー
画製剤製造業者に共有する。
・21 CFR 610.47でHCV陽性時の遡及調査を規定。 カーの陽転や輸血感染症への感染に関す
ウイルスプロセスバリデーションが実施され ただし、分画製剤の製造工程においてウイルスク る情報、輸血後感染症例で供血者が特定
ており、またはウイルスクリアランス指数9 リアランスのバリデーションがとれている場合は できる場合の供血者に関する情報等を入
が達成されている製剤、もしくは原料プール 不要
手次第、分画製剤メーカーに情報共有す
のNATが陰性である製剤で、原料血漿に
る
NAT陽性血液が混入していた(ことが後で
・遡及期間は直近の検査陰性の供血から少
判明した)場合は(原則として供給停止、回
なくとも6か月前の期間内とし、少なく
収、情報提供等の遡及調査は必要ないが)速
ともウインドウ期間の最長期間と同等と
やかに厚生労働省血液対策課に報告する。
する
・プール血漿にHIV、HAV、HBV、HCV、
vCJDが混入した場合、分画製剤メーカー
はリスク評価とともに各国の規制当局に
報告し、製品回収の要否等の指示を仰ぐ
・2か月間
・60日間* (21 CFR 640.69(f))
・適正な貯留保管期間(例えば60日間)を
設定することが望ましい
* 2020年4月からコロナパンデミックの影響緩和のた
8)
めFDAガイダンスにより45日間に短縮
1)Guideline on plasma-derived medicinal
1)令和2年8月27日付け薬生発0827第7号厚生 1)PPTA Donor History Questionnaire:
https://www.pptaglobal.org/safety-quality/donor-historyproducts:
労働省医薬・生活衛生局長通知「安全な血液 questionnaire
https://www.ema.europa.eu/en/docume
製剤の安定供給の確保等に関する法律第25 2)Use of the National Donor Deferral Registry Standard:
https://www.pptaglobal.org/images/IQPP_NDDR_V3_0.p
nts/scientific-guideline/guideline条に基づく健康診断並びに生物由来原料基準 df
第2の1(1)及び2(1)に規定する問診 3) Nucleic Acid Testing (NAT) for Human Immunodeficiency plasma-derived-medicinalVirus Type 1 (HIV-1) and Hepatitis C Virus (HCV):
products_en.pdf
等について」(令和4年3月30日一部改
Testing, Product Disposition, and Donor Deferral and
正)
Reentry: https://www.fda.gov/media/124144/download
of Nucleic Acid Tests on Pooled and Individual
2)厚生労働省「生物由来原料基準」(2003年5月 4)Use
Samples From Donors of Whole Blood and Blood
20日制定(平成15年厚生労働省告示第210
Components, Including Source Plasma, to Reduce the Risk
of Transmission of Hepatitis B Virus:
号)、最終改正2018年2月28日(平成30年
参考資料
https://www.fda.gov/media/124225/download
厚生労働省告示第37号))
5)
Guidance
for Industry :Nucleic Acid Testing (NAT) to
等
3)厚生労働省医薬・生活衛生局血液対策課「血 Reduce the Possible Risk of Human Parvovirus B19
Transmission by Plasma-Derived Products
液製剤等に係る遡及調査ガイドライン」(平
https://www.fda.gov/media/72156/download
6) QSEAL NAT Testing Standard:
成17年3月(令和3年9月一部改正))
https://www.pptaglobal.org/images/qseal/NATTestingV2.
7) American Red Cross:
https://www.redcrossblood.org/biomedical-services/blooddiagnostic-testing/blood-testing.html
8) Guidance for Industry : Alternative Procedures for Blood
and Blood Components During the COVID-19 Public
Health Emergency:
https://www.fda.gov/media/136603/download
5