よむ、つかう、まなぶ。
資 料4-2 令和4年度第1回安全技術調査会の審議結果について (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
いて当該ウイルスが十分に除去・不活化されることが確認できない場合、又は当
該製剤と感染症発生との因果関係が否定できない場合※注 13 には、感染拡大防止の
ため、当該製剤と同一ロットの製剤については、医療機関へ供給前であれば原則
として、直ちに当該製剤の供給を停止するとともに、供給後であれば、当該製剤
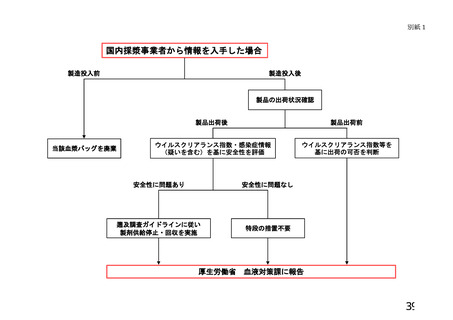
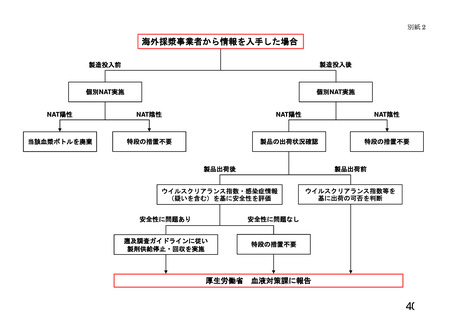
を提供した医療機関に対して、別紙2に示す情報提供を行う。
(ア)
対象製剤が未使用の場合
医療機関で使用前であれば直ちに回収を行う※注 14。
(イ)
対象製剤が使用されていた場合
当該医療機関において使用後であった場合、医療機関から当該患者に係
る製剤投与前後の検査結果があれば当該結果及び健康情報の提供並びに健
康状態のフォローアップを依頼する。
なお、指針に対応するような感染症検査を行っていない場合であって
も、患者保管検体がある場合は医療機関で検査を実施してもらうか、又は
プライバシーを配慮した上で検体を当該製造業者等へ提供してもらうよう
依頼する。
これらの情報については速やかに医薬品医療機器総合機構並びに同一原
料血漿由来の製剤を供給した他の医療機関及び血漿分画製剤の製造販売業
者等に提供する。
8 その他関係者の対応
(1) 衛生検査所の対応
指針における血液製剤投与前後の感染症検査には、医療機関における整備状況や
費用面から院内で実施できない検査項目がある。特に、十分な標準化がなされてい
ないと考えられる NAT 及び HCV コア抗原検査にあっては、感度の向上及び統一を図
る必要がある。
厚生労働省が中心となりコントロールサーベイを実施しており、衛生検査所はこ
れらの取組に協力する。
(2) 国の対応
ア 副作用感染症報告に対する対応の検討
医療機関及び製造業者等から医薬品医療機器総合機構への副作用感染症報告
(速報)において、劇症化例や死亡例など重大で緊急な対応が必要な場合、薬
事・食品衛生審議会血液事業部会運営委員会を緊急開催し、関係各課が連携し
て、今後の対応を検討するとともに、上記以外の例については定例会で状況を説
明する。この際、個人情報の保護等に留意するものとする。
13
18
該製剤と感染症発生との因果関係が否定できない場合※注 13 には、感染拡大防止の
ため、当該製剤と同一ロットの製剤については、医療機関へ供給前であれば原則
として、直ちに当該製剤の供給を停止するとともに、供給後であれば、当該製剤
を提供した医療機関に対して、別紙2に示す情報提供を行う。
(ア)
対象製剤が未使用の場合
医療機関で使用前であれば直ちに回収を行う※注 14。
(イ)
対象製剤が使用されていた場合
当該医療機関において使用後であった場合、医療機関から当該患者に係
る製剤投与前後の検査結果があれば当該結果及び健康情報の提供並びに健
康状態のフォローアップを依頼する。
なお、指針に対応するような感染症検査を行っていない場合であって
も、患者保管検体がある場合は医療機関で検査を実施してもらうか、又は
プライバシーを配慮した上で検体を当該製造業者等へ提供してもらうよう
依頼する。
これらの情報については速やかに医薬品医療機器総合機構並びに同一原
料血漿由来の製剤を供給した他の医療機関及び血漿分画製剤の製造販売業
者等に提供する。
8 その他関係者の対応
(1) 衛生検査所の対応
指針における血液製剤投与前後の感染症検査には、医療機関における整備状況や
費用面から院内で実施できない検査項目がある。特に、十分な標準化がなされてい
ないと考えられる NAT 及び HCV コア抗原検査にあっては、感度の向上及び統一を図
る必要がある。
厚生労働省が中心となりコントロールサーベイを実施しており、衛生検査所はこ
れらの取組に協力する。
(2) 国の対応
ア 副作用感染症報告に対する対応の検討
医療機関及び製造業者等から医薬品医療機器総合機構への副作用感染症報告
(速報)において、劇症化例や死亡例など重大で緊急な対応が必要な場合、薬
事・食品衛生審議会血液事業部会運営委員会を緊急開催し、関係各課が連携し
て、今後の対応を検討するとともに、上記以外の例については定例会で状況を説
明する。この際、個人情報の保護等に留意するものとする。
13
18