よむ、つかう、まなぶ。
資 料4-2 令和4年度第1回安全技術調査会の審議結果について (29 ページ)
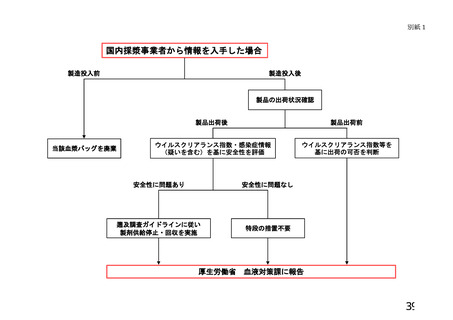
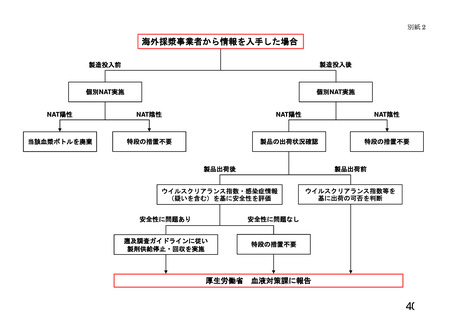
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
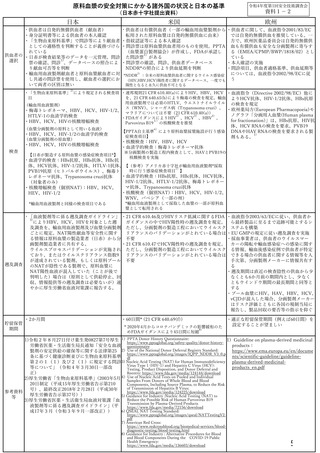
未使用の製剤があれば回収を行う。
HIV
可能な限り過去に遡り、過去の直近(前 ウエスタンブロット法及び個別 NAT のう
回)及び前回から過去 40 日以内のすべて ち、いずれか陽性の場合、可能な限り過
の輸血用血液製剤、原料血漿を遡及す
去に遡り、過去の直近(前回)及び前回
る。
から過去 40 日以内の全ての輸血用血液
なお、有効期間内にある輸血用血液製剤 製剤、原料血漿を遡及する。
については、供給を停止し、医療機関に なお、有効期間内にある輸血用血液製剤
未使用の製剤があれば回収を行う。
については、供給を停止し、医療機関に
未使用の製剤があれば回収を行う。
※上記遡及のほか、研究的に必要な調査を行い、必要時に見直し、審議会に諮ることとす
る。
※スクリーニング NAT 及び血清学的検査の重複陽転事例の場合は、血清学的検査陽転時の
遡及調査期間とする。
※医療機関からの感染症情報に基づく保管検体の調査で、個別 NAT 陽性となった場合は、
スクリーニング NAT 陽転時の前回血液と同様に扱う。
脚注の説明
※注1
頻回受血者(患者)の場合、3か月に1回程度を目安に実施することが望まれ
る。なお、年余にわたって輸血を受けると予想される患者には、HB ワクチンの実
施が望ましい。
※注2
検査項目の中には核酸増幅検査(以下「NAT」という。)等外注が必要なもの
もあることから、衛生検査所における感度及び特異度の確認も求められる(7
(1)及び(2)イ参照)。
※注3
製造業者、輸入販売業者及び販売業者
※注4
医薬品医療機器等法第 68 条の 10 第2項では厚生労働大臣への報告を規定して
いるが、同法第 68 条の 13 第1項及び第3項並びに医薬品、医療機器等の品質、
有効性及び安全性の確保等に関する法律施行令(昭和 36 年政令第 11 号)第 64
条の2の規定により、医薬品医療機器総合機構に報告することとされている。
22
27
HIV
可能な限り過去に遡り、過去の直近(前 ウエスタンブロット法及び個別 NAT のう
回)及び前回から過去 40 日以内のすべて ち、いずれか陽性の場合、可能な限り過
の輸血用血液製剤、原料血漿を遡及す
去に遡り、過去の直近(前回)及び前回
る。
から過去 40 日以内の全ての輸血用血液
なお、有効期間内にある輸血用血液製剤 製剤、原料血漿を遡及する。
については、供給を停止し、医療機関に なお、有効期間内にある輸血用血液製剤
未使用の製剤があれば回収を行う。
については、供給を停止し、医療機関に
未使用の製剤があれば回収を行う。
※上記遡及のほか、研究的に必要な調査を行い、必要時に見直し、審議会に諮ることとす
る。
※スクリーニング NAT 及び血清学的検査の重複陽転事例の場合は、血清学的検査陽転時の
遡及調査期間とする。
※医療機関からの感染症情報に基づく保管検体の調査で、個別 NAT 陽性となった場合は、
スクリーニング NAT 陽転時の前回血液と同様に扱う。
脚注の説明
※注1
頻回受血者(患者)の場合、3か月に1回程度を目安に実施することが望まれ
る。なお、年余にわたって輸血を受けると予想される患者には、HB ワクチンの実
施が望ましい。
※注2
検査項目の中には核酸増幅検査(以下「NAT」という。)等外注が必要なもの
もあることから、衛生検査所における感度及び特異度の確認も求められる(7
(1)及び(2)イ参照)。
※注3
製造業者、輸入販売業者及び販売業者
※注4
医薬品医療機器等法第 68 条の 10 第2項では厚生労働大臣への報告を規定して
いるが、同法第 68 条の 13 第1項及び第3項並びに医薬品、医療機器等の品質、
有効性及び安全性の確保等に関する法律施行令(昭和 36 年政令第 11 号)第 64
条の2の規定により、医薬品医療機器総合機構に報告することとされている。
22
27