よむ、つかう、まなぶ。
資 料4-2 令和4年度第1回安全技術調査会の審議結果について (50 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(案)
1 基本的考え方
平成 16 年8月 15 日以降の遡及調査について適用されている「輸血用血液等の遡及
調査に関するガイドライン」(以下「日赤作成ガイドライン」という。)は、日本赤十
字社が薬事・食品衛生審議会血液事業部会等の意見を踏まえて自主的に作成したもの
であるが、これは、病原体ごとの遡及調査期間を明示するとともに、主として供血者か
ら判明した感染事例についての日本赤十字社における遡及調査手順を示したものであ
り、医療機関における対応については日赤作成ガイドラインに係る通知(「血液製剤の
遡及調査について」)1)において、検体の保管方法等を示したに留まっていた。
平成 16 年7月の「輸血医療の安全性確保のための総合対策」において検討課題とな
っていた「輸血前後の感染症マーカー検査の在り方」について、平成 16 年9月 17 日
付け「輸血療法の実施に関する指針」の一部改訂に係る通知2)によって方向性が示さ
れたことなどから、医療機関からの情報に基づく遡及調査の実施方法等を明確にする
とともに、日本赤十字社、医療機関、衛生検査所及び血漿分画製剤の製造販売業者等で
の遡及調査に係る対応を明らかにし、国として遡及調査をより円滑に実施するために
平成 17 年3月「血液製剤等に係る遡及調査ガイドライン」(以下「本ガイドライン」
という。)が作成された。
その後、平成 20 年 12 月、平成 24 年3月、平成 26 年7月、平成 30 年3月及び令和
2年3月に改正が行われた後に、令和3年7月に開催された薬事・食品衛生審議会薬事
分科会血液事業部会安全技術調査会(以下「調査会」という。)において、血液製剤に
よる感染の事例等について詳しく精査され様々な検討が行われた。その結果、本ガイド
ラインは、感染被害の防止、受血者感染の早期発見・早期治療への誘導及び遡及調査に
係る分析・評価を通じて検査法の改良等の血液製剤の安全性向上に資するべきもので
あるとの委員からの意見を踏まえ、遡及調査の手順や検体の保存について示すだけで
なく、血液製剤に感染のリスクがあると考えられる場合における、製剤の供給停止又は
回収等の措置等も併せて示す必要があると結論づけられたことから、令和3年9月に
本ガイドラインの改正が行われた。また、その後、令和4年1月に開催された調査会に
おける、感染症スクリーニング陽転供(献)血者由来の過去の供(献)血時の血漿製剤
の取扱い及び遡及調査の対象とする病原体についての議論を踏まえ、令和4年5月に
本ガイドラインの改正が再度行われた。
なお、本ガイドラインは一定期間ごとに見直しを行うこととする。
2 遡及調査の定義
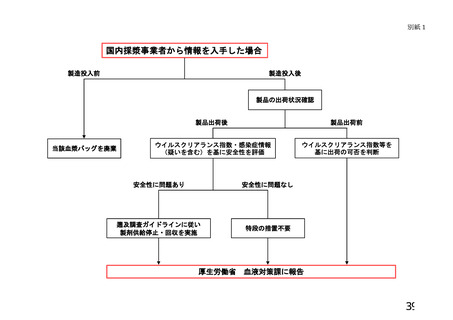
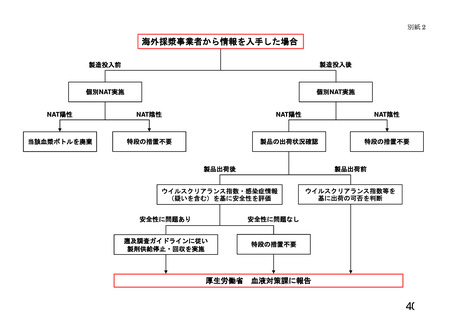
遡及調査とは、病原体の存在が疑われた供(献)血者の過去の供(献)血血液又は輸
血等により感染が疑われた血液製剤等に関する情報及びこれらの供(献)血血液から製
造された血液製剤の情報、当該製剤が投与された患者の感染に係る情報等を収集し、そ
れを科学的に分析・評価することである。
3
48
1 基本的考え方
平成 16 年8月 15 日以降の遡及調査について適用されている「輸血用血液等の遡及
調査に関するガイドライン」(以下「日赤作成ガイドライン」という。)は、日本赤十
字社が薬事・食品衛生審議会血液事業部会等の意見を踏まえて自主的に作成したもの
であるが、これは、病原体ごとの遡及調査期間を明示するとともに、主として供血者か
ら判明した感染事例についての日本赤十字社における遡及調査手順を示したものであ
り、医療機関における対応については日赤作成ガイドラインに係る通知(「血液製剤の
遡及調査について」)1)において、検体の保管方法等を示したに留まっていた。
平成 16 年7月の「輸血医療の安全性確保のための総合対策」において検討課題とな
っていた「輸血前後の感染症マーカー検査の在り方」について、平成 16 年9月 17 日
付け「輸血療法の実施に関する指針」の一部改訂に係る通知2)によって方向性が示さ
れたことなどから、医療機関からの情報に基づく遡及調査の実施方法等を明確にする
とともに、日本赤十字社、医療機関、衛生検査所及び血漿分画製剤の製造販売業者等で
の遡及調査に係る対応を明らかにし、国として遡及調査をより円滑に実施するために
平成 17 年3月「血液製剤等に係る遡及調査ガイドライン」(以下「本ガイドライン」
という。)が作成された。
その後、平成 20 年 12 月、平成 24 年3月、平成 26 年7月、平成 30 年3月及び令和
2年3月に改正が行われた後に、令和3年7月に開催された薬事・食品衛生審議会薬事
分科会血液事業部会安全技術調査会(以下「調査会」という。)において、血液製剤に
よる感染の事例等について詳しく精査され様々な検討が行われた。その結果、本ガイド
ラインは、感染被害の防止、受血者感染の早期発見・早期治療への誘導及び遡及調査に
係る分析・評価を通じて検査法の改良等の血液製剤の安全性向上に資するべきもので
あるとの委員からの意見を踏まえ、遡及調査の手順や検体の保存について示すだけで
なく、血液製剤に感染のリスクがあると考えられる場合における、製剤の供給停止又は
回収等の措置等も併せて示す必要があると結論づけられたことから、令和3年9月に
本ガイドラインの改正が行われた。また、その後、令和4年1月に開催された調査会に
おける、感染症スクリーニング陽転供(献)血者由来の過去の供(献)血時の血漿製剤
の取扱い及び遡及調査の対象とする病原体についての議論を踏まえ、令和4年5月に
本ガイドラインの改正が再度行われた。
なお、本ガイドラインは一定期間ごとに見直しを行うこととする。
2 遡及調査の定義
遡及調査とは、病原体の存在が疑われた供(献)血者の過去の供(献)血血液又は輸
血等により感染が疑われた血液製剤等に関する情報及びこれらの供(献)血血液から製
造された血液製剤の情報、当該製剤が投与された患者の感染に係る情報等を収集し、そ
れを科学的に分析・評価することである。
3
48