よむ、つかう、まなぶ。
資 料4-2 令和4年度第1回安全技術調査会の審議結果について (69 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(案)
から、先進各国でも対象としていないこと、(2)血液の低温保管中で死滅するとい
う報告があること、(3)日本赤十字社が血液製剤を供給する体制がとられてから報
告がないこと等から、対象範囲から除外することとした。」とされている。
※注3
頻回受血者(患者)の場合、3か月に1回程度を目安に実施することが望まれる。
なお、年余にわたって輸血を受けると予想される患者には、HB ワクチンの実施が
望ましい。
※注4
検査項目の中には核酸増幅検査(以下「NAT」という。)等外注が必要なものも
あることから、衛生検査所における感度及び特異度の確認も求められる(8(1)
及び(2)イ参照)。
※注5
製造業者、輸入販売業者及び販売業者
※注6
医薬品医療機器等法第 68 条の 10 第2項では厚生労働大臣への報告を規定して
いるが、同法第 68 条の 13 第1項及び第3項並びに医薬品、医療機器等の品質、有
効性及び安全性の確保等に関する法律施行令(昭和 36 年政令第 11 号)第 64 条の
2の規定により、医薬品医療機器総合機構に報告することとされている。
※注7
同時採血分に限る。
※注8
患者の対応においては以下のことに留意すること。
<輸血用血液製剤>
○
一般的に輸血用血液製剤は、現在の科学水準の下では技術的にウイルス等の
混入による感染のリスクを完全には排除できないこと。同時に HBV の感染既往
者における肝炎の重篤化及び院内感染等の輸血用血液製剤以外の原因もあり得
ること。
○
患者に対する輸血用血液製剤投与前後の感染症検査については、指針に従い
実施すること。なお、当該検査の診療報酬の請求に当たっては、輸血用血液製剤
を投与した日時を診療報酬明細書に記載するなど、実施の理由を明確にするよ
う留意すること。
<血漿分画製剤>
○
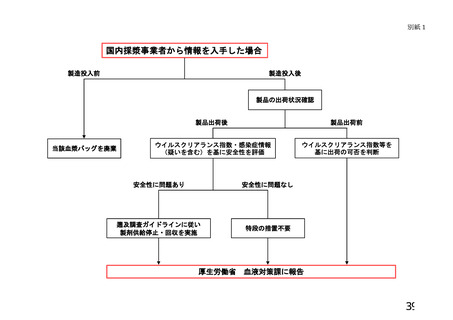
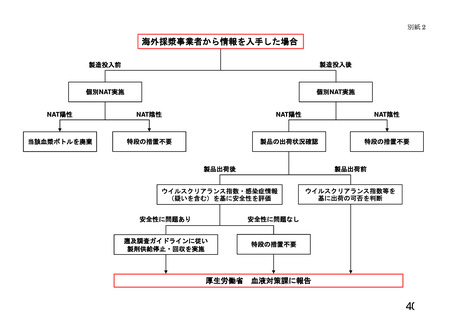
現在の血漿分画製剤については、その原材料である血漿についてミニプール
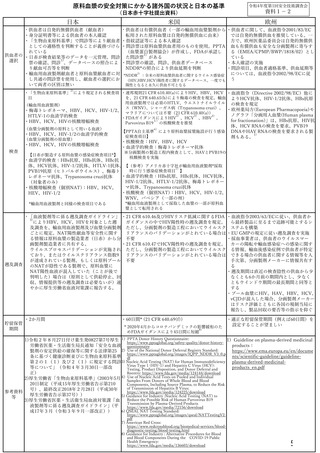
NAT あるいは個別 NAT を実施し、ウイルスの DNA 又は RNA が検出されないことを
確認したものを使用しているが、当該ミニプールあるいは個別 NAT の検出限界
以下のウイルスが混入している可能性が常に存在する。
しかし、既知のエンベロープを有するウイルス、特に今回対象となっている病
原体に対しては、平成 15 年 10 月 24 日に開催された平成 15 年度第3回血液事
業部会における検討結果を踏まえ、製造工程においてウイルスクリアランス指
22
67
から、先進各国でも対象としていないこと、(2)血液の低温保管中で死滅するとい
う報告があること、(3)日本赤十字社が血液製剤を供給する体制がとられてから報
告がないこと等から、対象範囲から除外することとした。」とされている。
※注3
頻回受血者(患者)の場合、3か月に1回程度を目安に実施することが望まれる。
なお、年余にわたって輸血を受けると予想される患者には、HB ワクチンの実施が
望ましい。
※注4
検査項目の中には核酸増幅検査(以下「NAT」という。)等外注が必要なものも
あることから、衛生検査所における感度及び特異度の確認も求められる(8(1)
及び(2)イ参照)。
※注5
製造業者、輸入販売業者及び販売業者
※注6
医薬品医療機器等法第 68 条の 10 第2項では厚生労働大臣への報告を規定して
いるが、同法第 68 条の 13 第1項及び第3項並びに医薬品、医療機器等の品質、有
効性及び安全性の確保等に関する法律施行令(昭和 36 年政令第 11 号)第 64 条の
2の規定により、医薬品医療機器総合機構に報告することとされている。
※注7
同時採血分に限る。
※注8
患者の対応においては以下のことに留意すること。
<輸血用血液製剤>
○
一般的に輸血用血液製剤は、現在の科学水準の下では技術的にウイルス等の
混入による感染のリスクを完全には排除できないこと。同時に HBV の感染既往
者における肝炎の重篤化及び院内感染等の輸血用血液製剤以外の原因もあり得
ること。
○
患者に対する輸血用血液製剤投与前後の感染症検査については、指針に従い
実施すること。なお、当該検査の診療報酬の請求に当たっては、輸血用血液製剤
を投与した日時を診療報酬明細書に記載するなど、実施の理由を明確にするよ
う留意すること。
<血漿分画製剤>
○
現在の血漿分画製剤については、その原材料である血漿についてミニプール
NAT あるいは個別 NAT を実施し、ウイルスの DNA 又は RNA が検出されないことを
確認したものを使用しているが、当該ミニプールあるいは個別 NAT の検出限界
以下のウイルスが混入している可能性が常に存在する。
しかし、既知のエンベロープを有するウイルス、特に今回対象となっている病
原体に対しては、平成 15 年 10 月 24 日に開催された平成 15 年度第3回血液事
業部会における検討結果を踏まえ、製造工程においてウイルスクリアランス指
22
67