よむ、つかう、まなぶ。
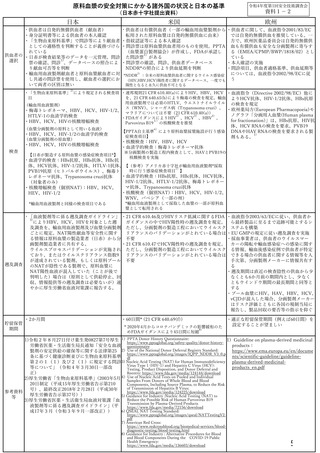
資 料4-2 令和4年度第1回安全技術調査会の審議結果について (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別紙2
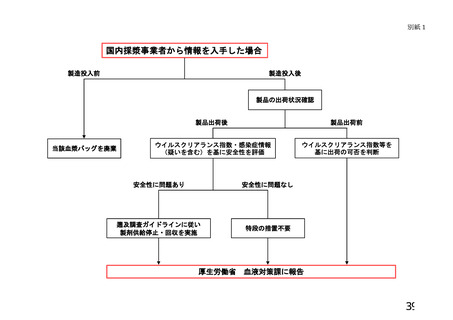
「製造業者等が医療機関等へ提供する情報について」
1 遡及調査に至った経緯に関する情報
医療機関に納入された血液製剤等が、ウインドウ期に採取された可能性のある血液を
原料としていることが判明したこと。
2 対象となる血液製剤等に関する情報
対象製剤に係る以下の情報。
(1) 名称
(2) 製造番号、医療機関への納入年月日、納入数量
(3) 対象製剤の原料となった血液の供(献)血年月日及び当該血液にウイルス等が混
入していること、又は、混入の可能性が判明した年月日
(4) 対象製剤の原料となった血液について製造業者等が実施した病原微生物検査の種
類及び検査結果
(5) 対象製剤の原料となった血液を供(献)血した後に供(献)血していた場合は、
当該血液についての病原微生物検査の検査結果
(6) 遡及調査に伴い追加的に病原微生物検査を実施した場合は、その検査結果
3 危惧される具体的な健康被害に関する情報
(1) 上記2の(3)~(6)に掲げる結果に基づき、対象製剤について当該製造業者
等がリスク評価(別添1参照)を行った結果。
(2) 医療機関が当該製造業者の実施したリスク評価の結果を確認できるよう、別添2
に規定する当該製造業者における病原微生物検査に関連する技術的基礎情報。
4 当該製造業者等担当者に関する情報
当該製造業者等において医療機関との連絡の窓口となる担当者の氏名、連絡先等
18
23
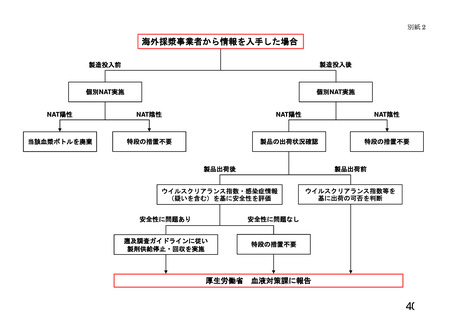
「製造業者等が医療機関等へ提供する情報について」
1 遡及調査に至った経緯に関する情報
医療機関に納入された血液製剤等が、ウインドウ期に採取された可能性のある血液を
原料としていることが判明したこと。
2 対象となる血液製剤等に関する情報
対象製剤に係る以下の情報。
(1) 名称
(2) 製造番号、医療機関への納入年月日、納入数量
(3) 対象製剤の原料となった血液の供(献)血年月日及び当該血液にウイルス等が混
入していること、又は、混入の可能性が判明した年月日
(4) 対象製剤の原料となった血液について製造業者等が実施した病原微生物検査の種
類及び検査結果
(5) 対象製剤の原料となった血液を供(献)血した後に供(献)血していた場合は、
当該血液についての病原微生物検査の検査結果
(6) 遡及調査に伴い追加的に病原微生物検査を実施した場合は、その検査結果
3 危惧される具体的な健康被害に関する情報
(1) 上記2の(3)~(6)に掲げる結果に基づき、対象製剤について当該製造業者
等がリスク評価(別添1参照)を行った結果。
(2) 医療機関が当該製造業者の実施したリスク評価の結果を確認できるよう、別添2
に規定する当該製造業者における病原微生物検査に関連する技術的基礎情報。
4 当該製造業者等担当者に関する情報
当該製造業者等において医療機関との連絡の窓口となる担当者の氏名、連絡先等
18
23