よむ、つかう、まなぶ。
総-2別紙3厚生労働大臣が指定する病院の病棟における療養に要する費用の額の算定方法 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_70414.html |
| 出典情報 | 中央社会保険医療協議会 総会(第647回 2/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
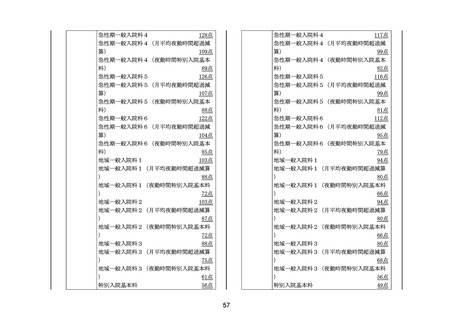
128まで(既装着のギプス包帯をギプスシャーレとして
切割使用した場合を除く。)、J129(2に限る。ただ
し、既装着のギプス包帯をギプスシャーレとして切割使用
した場合を除く。)及びJ129-2(2に限る。ただし
、既装着のギプス包帯をギプスシャーレとして切割使用し
た場合を除く。)に掲げる処置料並びにJ038(1から
3までに限る。)に掲げる人工腎臓に当たって使用した保
険医療材料(特定保険医療材料及びその材料価格(材料価
格基準)(平成20年厚生労働省告示第61号。以下「材料価
格基準」という。)別表Ⅱ区分040(1)及び(5)に掲げる材
かん
料に限る。)並びにJ042に掲げる腹膜灌流(1に限る
かん
。)に当たって使用した薬剤(腹膜灌流液に限る。)及び
保険医療材料(材料価格基準別表Ⅱ区分051から区分0
53までに掲げる材料に限る。)に係る費用
(9) 病理標本作製料のうち、区分番号N003に掲げる費用
(10) HIV感染症の患者に使用する抗HIV薬に係る費用
(11) 血友病等の患者に使用する遺伝子組換え活性型血液凝固
第Ⅶ因子製剤、遺伝子組換え型血液凝固第Ⅷ因子製剤、血
液凝固第Ⅷ因子機能代替製剤、遺伝子組換え型血液凝固第
Ⅸ因子製剤、乾燥人血液凝固第Ⅷ因子製剤、乾燥人血液凝
固第Ⅸ因子製剤(活性化プロトロンビン複合体及び乾燥人
う
血液凝固因子抗体迂回活性複合体を含む。)、乾燥濃縮人
血液凝固第Ⅹ因子加活性化第Ⅶ因子製剤、遺伝子組換えヒ
トvon Willebrand因子製剤及び抗TFPIモノクローナル抗体
に係る費用
3 所定点数に含まれていない費用については、医科点数表又は
歯科点数表により算定する。
4 3の規定にかかわらず、別に厚生労働大臣が定める病院(医
科点数表区分番号A104に掲げる特定機能病院入院基本料に
係る届出を行った病院に限る。以下「4に規定する病院」とい
う。)であって、医科点数表第1章第2部第3節特定入院料の
合を除く。)、J129(2に限る。ただし、既装着のギ
プス包帯をギプスシャーレとして切割使用した場合を除く
。)及びJ129-2(2に限る。ただし、既装着のギプ
ス包帯をギプスシャーレとして切割使用した場合を除く。
)に掲げる処置料並びにJ038(1から3までに限る。
)に掲げる人工腎臓に当たって使用した保険医療材料(特
定保険医療材料及びその材料価格(材料価格基準)(平成
20年厚生労働省告示第61号。以下「材料価格基準」という
。)別表Ⅱ区分040(1)及び(5)に掲げる材料に限る。)並
かん
びにJ042に掲げる腹膜灌流(1に限る。)に当たって
かん
使用した薬剤(腹膜灌流液に限る。)及び保険医療材料(
材料価格基準別表Ⅱ区分051から区分053までに掲げ
る材料に限る。)に係る費用
(9)
(10)
(11)
病理標本作製料のうち、区分番号N003に掲げる費用
HIV感染症の患者に使用する抗HIV薬に係る費用
血友病等の患者に使用する遺伝子組換え活性型血液凝固
第Ⅶ因子製剤、遺伝子組換え型血液凝固第Ⅷ因子製剤、血
液凝固第Ⅷ因子機能代替製剤、遺伝子組換え型血液凝固第
Ⅸ因子製剤、乾燥人血液凝固第Ⅷ因子製剤、乾燥人血液凝
固第Ⅸ因子製剤(活性化プロトロンビン複合体及び乾燥人
う
血液凝固因子抗体迂回活性複合体を含む。)、乾燥濃縮人
血液凝固第Ⅹ因子加活性化第Ⅶ因子製剤、遺伝子組換えヒ
トvon Willebrand因子製剤及び抗TFPIモノクローナル抗体
に係る費用
3 所定点数に含まれていない費用については、医科点数表又は
歯科点数表により算定する。
4 3の規定にかかわらず、別に厚生労働大臣が定める病院(医
科点数表区分番号A104に掲げる特定機能病院入院基本料に
係る届出を行った病院に限る。以下「4に規定する病院」とい
う。)であって、医科点数表第1章第2部第3節特定入院料の
7
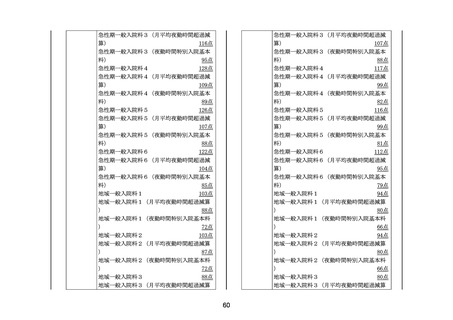
切割使用した場合を除く。)、J129(2に限る。ただ
し、既装着のギプス包帯をギプスシャーレとして切割使用
した場合を除く。)及びJ129-2(2に限る。ただし
、既装着のギプス包帯をギプスシャーレとして切割使用し
た場合を除く。)に掲げる処置料並びにJ038(1から
3までに限る。)に掲げる人工腎臓に当たって使用した保
険医療材料(特定保険医療材料及びその材料価格(材料価
格基準)(平成20年厚生労働省告示第61号。以下「材料価
格基準」という。)別表Ⅱ区分040(1)及び(5)に掲げる材
かん
料に限る。)並びにJ042に掲げる腹膜灌流(1に限る
かん
。)に当たって使用した薬剤(腹膜灌流液に限る。)及び
保険医療材料(材料価格基準別表Ⅱ区分051から区分0
53までに掲げる材料に限る。)に係る費用
(9) 病理標本作製料のうち、区分番号N003に掲げる費用
(10) HIV感染症の患者に使用する抗HIV薬に係る費用
(11) 血友病等の患者に使用する遺伝子組換え活性型血液凝固
第Ⅶ因子製剤、遺伝子組換え型血液凝固第Ⅷ因子製剤、血
液凝固第Ⅷ因子機能代替製剤、遺伝子組換え型血液凝固第
Ⅸ因子製剤、乾燥人血液凝固第Ⅷ因子製剤、乾燥人血液凝
固第Ⅸ因子製剤(活性化プロトロンビン複合体及び乾燥人
う
血液凝固因子抗体迂回活性複合体を含む。)、乾燥濃縮人
血液凝固第Ⅹ因子加活性化第Ⅶ因子製剤、遺伝子組換えヒ
トvon Willebrand因子製剤及び抗TFPIモノクローナル抗体
に係る費用
3 所定点数に含まれていない費用については、医科点数表又は
歯科点数表により算定する。
4 3の規定にかかわらず、別に厚生労働大臣が定める病院(医
科点数表区分番号A104に掲げる特定機能病院入院基本料に
係る届出を行った病院に限る。以下「4に規定する病院」とい
う。)であって、医科点数表第1章第2部第3節特定入院料の
合を除く。)、J129(2に限る。ただし、既装着のギ
プス包帯をギプスシャーレとして切割使用した場合を除く
。)及びJ129-2(2に限る。ただし、既装着のギプ
ス包帯をギプスシャーレとして切割使用した場合を除く。
)に掲げる処置料並びにJ038(1から3までに限る。
)に掲げる人工腎臓に当たって使用した保険医療材料(特
定保険医療材料及びその材料価格(材料価格基準)(平成
20年厚生労働省告示第61号。以下「材料価格基準」という
。)別表Ⅱ区分040(1)及び(5)に掲げる材料に限る。)並
かん
びにJ042に掲げる腹膜灌流(1に限る。)に当たって
かん
使用した薬剤(腹膜灌流液に限る。)及び保険医療材料(
材料価格基準別表Ⅱ区分051から区分053までに掲げ
る材料に限る。)に係る費用
(9)
(10)
(11)
病理標本作製料のうち、区分番号N003に掲げる費用
HIV感染症の患者に使用する抗HIV薬に係る費用
血友病等の患者に使用する遺伝子組換え活性型血液凝固
第Ⅶ因子製剤、遺伝子組換え型血液凝固第Ⅷ因子製剤、血
液凝固第Ⅷ因子機能代替製剤、遺伝子組換え型血液凝固第
Ⅸ因子製剤、乾燥人血液凝固第Ⅷ因子製剤、乾燥人血液凝
固第Ⅸ因子製剤(活性化プロトロンビン複合体及び乾燥人
う
血液凝固因子抗体迂回活性複合体を含む。)、乾燥濃縮人
血液凝固第Ⅹ因子加活性化第Ⅶ因子製剤、遺伝子組換えヒ
トvon Willebrand因子製剤及び抗TFPIモノクローナル抗体
に係る費用
3 所定点数に含まれていない費用については、医科点数表又は
歯科点数表により算定する。
4 3の規定にかかわらず、別に厚生労働大臣が定める病院(医
科点数表区分番号A104に掲げる特定機能病院入院基本料に
係る届出を行った病院に限る。以下「4に規定する病院」とい
う。)であって、医科点数表第1章第2部第3節特定入院料の
7