よむ、つかう、まなぶ。
03資料1-1森野委員提出資料(高齢者に対するインフルエンザワクチンファクトシート) (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64997.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第32回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
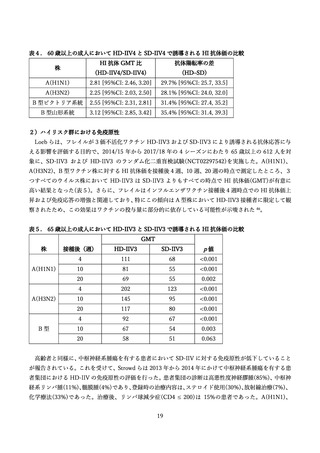
験者も組入れられていた。合併症の有無別に安全性を検討した結果、HD-IIV4 群および SD-IIV4 群とも
に、合併症を有する集団と有しない集団で、AE の発現割合に明確な差は認めらないと、審査報告書にも
記載されている 66。システマティックレビューによると、悪性腫瘍および関節リウマチがあるハイリスク
集団においても、高用量ワクチンによる発現割合には有意な差がないことが報告された 75。また、HIV お
よび固形臓器移植(SOT)患者などの免疫不全状態の集団においても、同様の考察が別のシステマティッ
クレビューでなされている 77。SOT 患者を対象としたシステマティックレビューでは、高用量群は標準
用量群より、注射部位反応や全身性の有害事象の頻度が高い傾向にあったと報告されている 78。一方で、
重要な安全性の懸念である移植片拒絶反応のリスクは、両群で同程度であった 78。
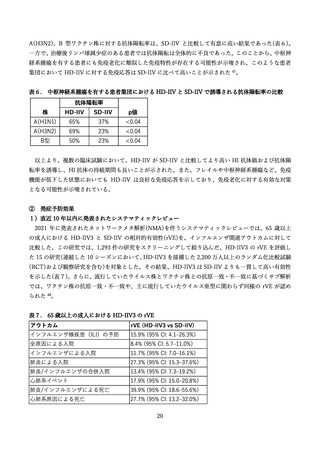
2)過去のインフルエンザワクチン接種歴
海外の臨床試験(FIM12・QHD13)において、被験者の 70%〜80%が前年に接種歴があったが、安全性
に関する懸念は論じられていない 65,67。海外第3相の QHD11 試験においては、前年接種歴の有無によ
る、接種 28 日後の抗体価を比較しているが、安全性データに関する詳細データは提示されなかった 68。
3)他のワクチンとの同時接種
HD-IIV4 と COVID-19 mRNA ワクチン(mRNA-1273)の 3 回目接種を同時接種した際の安全性と評価
した海外第 2 相試験が実施された 79。この試験では、65 歳以上で mRNA-1273 の初回シリーズ接種を完
了した成人を対象とし、同時接種群(99 例)、HD-IIV4 単独群(92 例)、mRNA-1273 単独群(104 例)で安
全性を比較した。接種後 7 日間の注射部位および全身性の特定反応は、同時接種群・mRNA-1273 単独群
が HD-IIV4 単独群より高く報告された。これは主に mRNA-1273 ワクチンの反応原性に起因するものと
考えられ、報告された反応の多くは軽度から中等度であった。接種後 22 日目までに、SAE、AESI、死亡
例はいずれの群でも報告されなかった。
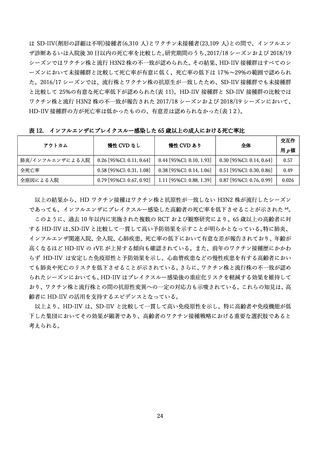
米国の VAERS の研究においては、HD-IIV3 接種者の 28.4%が肺炎球菌ワクチンを同日に接種してい
たとの記載があるも、安全性に関する特別な記載はなかった 71。米国メディケアにおける安全性能動的監
視研究においては、高用量を含めた全てのインフルエンザワクチンと肺炎球菌・B 肝炎・破傷風ワクチン
の同時接種による GBS 発症リスクは上昇を認めなかった 73。
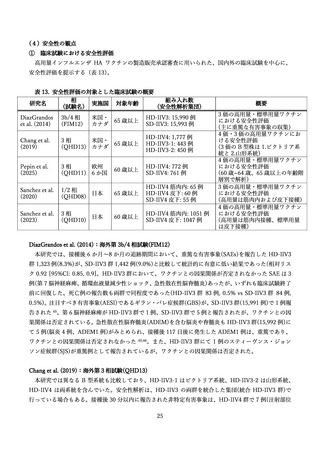
(5)医療経済学的な観点
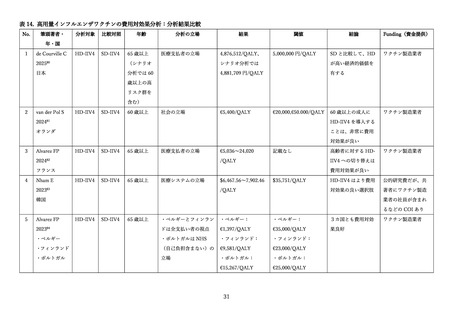
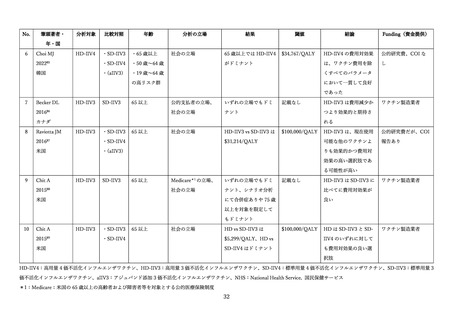
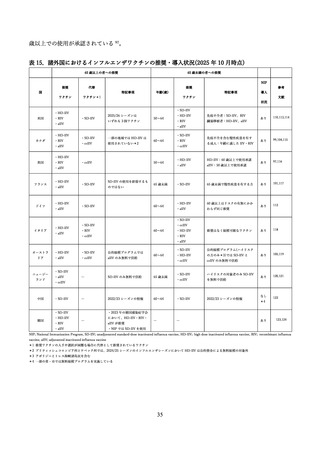
高齢者に対する3価または4価の HD-IIV と3価または4価の SD-IIV を直接比較し、QALY(Qualityadjusted life year、質調整生存年)を効果指標とした費用効果分析の研究に関するレビューを実施した(表
14)
。
2025 年 5 月 1 日時点で、PubMed を用いて、
「Cost」
「QALY」
「High-dose influenza vaccine」をキー
ワードとして検索を行ったところ、25 件の文献が抽出された。このうち、HD-IIV3 または HD-IIV4 を、
SD-IIV3 または SD-IIV4 と直接比較した費用効果分析は 10 文献であり、
HD-IIV4 を扱った研究が6件、
HD-IIV3 が4件であった。
研究の対象国は米国(3 件)
、韓国(2 件)、日本、オランダ、フランス、カナダが1件ずつ、さらにベ
ルギー、フィンランド、ポルトガルを同時に評価した研究が1件あった。
分析の立場は、社会の立場が6件、医療システムの立場等の支払い者の立場が6件(重複2件)であっ
29
に、合併症を有する集団と有しない集団で、AE の発現割合に明確な差は認めらないと、審査報告書にも
記載されている 66。システマティックレビューによると、悪性腫瘍および関節リウマチがあるハイリスク
集団においても、高用量ワクチンによる発現割合には有意な差がないことが報告された 75。また、HIV お
よび固形臓器移植(SOT)患者などの免疫不全状態の集団においても、同様の考察が別のシステマティッ
クレビューでなされている 77。SOT 患者を対象としたシステマティックレビューでは、高用量群は標準
用量群より、注射部位反応や全身性の有害事象の頻度が高い傾向にあったと報告されている 78。一方で、
重要な安全性の懸念である移植片拒絶反応のリスクは、両群で同程度であった 78。
2)過去のインフルエンザワクチン接種歴
海外の臨床試験(FIM12・QHD13)において、被験者の 70%〜80%が前年に接種歴があったが、安全性
に関する懸念は論じられていない 65,67。海外第3相の QHD11 試験においては、前年接種歴の有無によ
る、接種 28 日後の抗体価を比較しているが、安全性データに関する詳細データは提示されなかった 68。
3)他のワクチンとの同時接種
HD-IIV4 と COVID-19 mRNA ワクチン(mRNA-1273)の 3 回目接種を同時接種した際の安全性と評価
した海外第 2 相試験が実施された 79。この試験では、65 歳以上で mRNA-1273 の初回シリーズ接種を完
了した成人を対象とし、同時接種群(99 例)、HD-IIV4 単独群(92 例)、mRNA-1273 単独群(104 例)で安
全性を比較した。接種後 7 日間の注射部位および全身性の特定反応は、同時接種群・mRNA-1273 単独群
が HD-IIV4 単独群より高く報告された。これは主に mRNA-1273 ワクチンの反応原性に起因するものと
考えられ、報告された反応の多くは軽度から中等度であった。接種後 22 日目までに、SAE、AESI、死亡
例はいずれの群でも報告されなかった。
米国の VAERS の研究においては、HD-IIV3 接種者の 28.4%が肺炎球菌ワクチンを同日に接種してい
たとの記載があるも、安全性に関する特別な記載はなかった 71。米国メディケアにおける安全性能動的監
視研究においては、高用量を含めた全てのインフルエンザワクチンと肺炎球菌・B 肝炎・破傷風ワクチン
の同時接種による GBS 発症リスクは上昇を認めなかった 73。
(5)医療経済学的な観点
高齢者に対する3価または4価の HD-IIV と3価または4価の SD-IIV を直接比較し、QALY(Qualityadjusted life year、質調整生存年)を効果指標とした費用効果分析の研究に関するレビューを実施した(表
14)
。
2025 年 5 月 1 日時点で、PubMed を用いて、
「Cost」
「QALY」
「High-dose influenza vaccine」をキー
ワードとして検索を行ったところ、25 件の文献が抽出された。このうち、HD-IIV3 または HD-IIV4 を、
SD-IIV3 または SD-IIV4 と直接比較した費用効果分析は 10 文献であり、
HD-IIV4 を扱った研究が6件、
HD-IIV3 が4件であった。
研究の対象国は米国(3 件)
、韓国(2 件)、日本、オランダ、フランス、カナダが1件ずつ、さらにベ
ルギー、フィンランド、ポルトガルを同時に評価した研究が1件あった。
分析の立場は、社会の立場が6件、医療システムの立場等の支払い者の立場が6件(重複2件)であっ
29