よむ、つかう、まなぶ。
03資料1-1森野委員提出資料(高齢者に対するインフルエンザワクチンファクトシート) (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64997.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第32回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(4) 安全性の観点
①
臨床試験における安全性評価
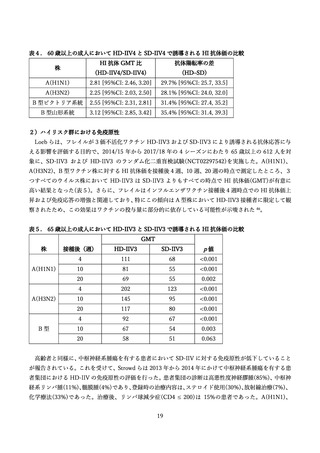
高用量インフルエンザ HA ワクチンの製造販売承認審査に用いられた、国内外の臨床試験を中心に、
安全性評価を提示する(表 13)
。
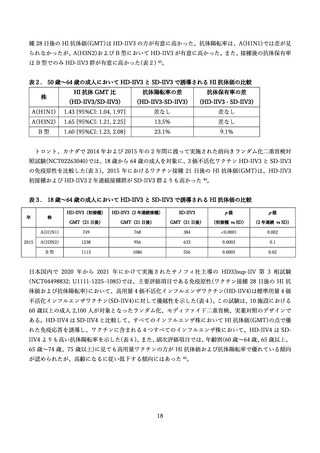
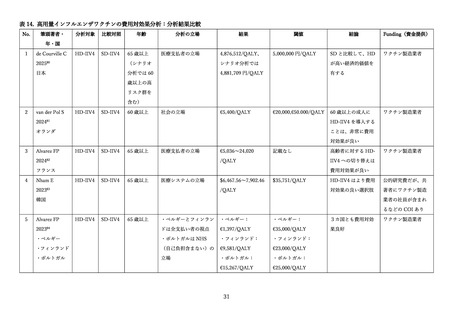
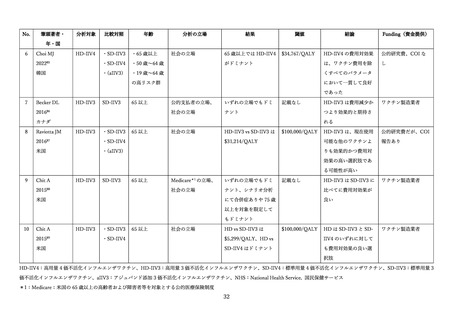
表 13. 安全性評価の対象とした臨床試験の概要
相
組み入れ数
研究名
実施国 対象年齢
(試験名)
(安全性解析集団)
DiazGrandos
et al. (2014)
3b/4 相
(FIM12)
米国・
65 歳以上
カナダ
HD-IIV3: 15,990 例
SD-IIV3: 15,993 例
Chang et al.
(2019)
3相
米国・
65 歳以上
(QHD13) カナダ
HD-IIV4: 1,777 例
HD-IIV3-1: 443 例
HD-IIV3-2: 450 例
Pepin et al.
(2025)
3相
欧州
(QHD11) 6 か国
60 歳以上
HD-IIV4: 772 例
SD-IIV4: 761 例
Sanchez et al.
(2020)
1/2 相
日本
(QHD08)
65 歳以上
HD-IIV4 筋肉内: 65 例
HD-IIV4 皮下: 60 例
SD-IIV4 皮下: 55 例
Sanchez et al.
(2023)
3相
日本
(QHD10)
60 歳以上
HD-IIV4 筋肉内: 1051 例
SD-IIV4 皮下: 1047 例
概要
3 価の高用量・標準用量ワクチン
における安全性評価
(主に重篤な有害事象の収集)
4 価・3 価の高用量ワクチンにお
ける安全性評価
(3 価の B 型株は 1.ビクトリア系
統と 2.山形系統)
4 価の高用量・標準用量ワクチン
における安全性評価
(60 歳~64 歳、65 歳以上の年齢階
層別で解析)
3 価の高用量・標準用量ワクチン
における安全性評価
(高用量は筋肉内および皮下接種)
4 価の高用量・標準用量ワクチン
における安全性評価
(高用量は筋肉内接種、標準用量
は皮下接種)
DiazGrandos et al. (2014):海外第 3b/4 相試験(FIM12)
本研究では、接種後 6 か月〜8 か月の追跡期間において、重篤な有害事象(SAEs)を報告した HD-IIV3
群 1,323 例(8.3%)が、SD-IIV3 群 1,442 例(9.0%)と比較して統計的に有意に低い結果であった(相対リス
ク 0.92 [95%CI: 0.85, 0.9]。HD-IIV3 群において、ワクチンとの因果関係が否定されなかった SAE は 3
例(第 7 脳神経麻痺、循環血液量減少性ショック、急性散在性脳脊髄炎)あったが、いずれも臨床試験終了
前に回復した。死亡例の報告数も両群で同程度であった(HD-IIV3 群 83 例, 0.5% vs SD-IIV3 群 84 例,
0.5%)。注目すべき有害事象(AESI)であるギラン・バレ症候群(GBS)が、SD-IIV3 群(15,991 例)で 1 例報
告された 65。第 6 脳神経麻痺が HD-IIV3 群で 1 例、SD-IIV3 群で 5 例と報告されたが、ワクチンとの因
果関係は否定されている。急性散在性脳脊髄炎(ADEM)を含む脳炎や脊髄炎も HD-IIV3 群(15,992 例)に
て 5 例(脳炎 4 例、ADEM1 例)がみとめられ、接種後 117 日後に発生した ADEM1 例は、重篤であり、
ワクチンとの因果関係は否定されなかった 65,66。また、HD-IIV3 群にて 1 例のスティーヴンス・ジョン
ソン症候群(SJS)が重篤例として報告されているが、ワクチンとの因果関係は否定された。
Chang et al. (2019):海外第3相試験(QHD13)
本研究では異なる B 型系統も比較しており、HD-IIV3-1 はビクトリア系統、HD-IIV3-2 は山形系統、
HD-IIV4 は両系統を含んでいた。安全性解析は、HD-IIV3 の両群を統合した集団(統合 HD-IIV3 群)で
行っている場合もある。接種後 30 分以内に報告された非特定有害事象は、HD-IIV4 群で 7 例(注射部位
25
①
臨床試験における安全性評価
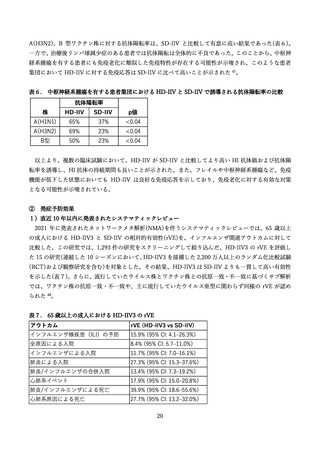
高用量インフルエンザ HA ワクチンの製造販売承認審査に用いられた、国内外の臨床試験を中心に、
安全性評価を提示する(表 13)
。
表 13. 安全性評価の対象とした臨床試験の概要
相
組み入れ数
研究名
実施国 対象年齢
(試験名)
(安全性解析集団)
DiazGrandos
et al. (2014)
3b/4 相
(FIM12)
米国・
65 歳以上
カナダ
HD-IIV3: 15,990 例
SD-IIV3: 15,993 例
Chang et al.
(2019)
3相
米国・
65 歳以上
(QHD13) カナダ
HD-IIV4: 1,777 例
HD-IIV3-1: 443 例
HD-IIV3-2: 450 例
Pepin et al.
(2025)
3相
欧州
(QHD11) 6 か国
60 歳以上
HD-IIV4: 772 例
SD-IIV4: 761 例
Sanchez et al.
(2020)
1/2 相
日本
(QHD08)
65 歳以上
HD-IIV4 筋肉内: 65 例
HD-IIV4 皮下: 60 例
SD-IIV4 皮下: 55 例
Sanchez et al.
(2023)
3相
日本
(QHD10)
60 歳以上
HD-IIV4 筋肉内: 1051 例
SD-IIV4 皮下: 1047 例
概要
3 価の高用量・標準用量ワクチン
における安全性評価
(主に重篤な有害事象の収集)
4 価・3 価の高用量ワクチンにお
ける安全性評価
(3 価の B 型株は 1.ビクトリア系
統と 2.山形系統)
4 価の高用量・標準用量ワクチン
における安全性評価
(60 歳~64 歳、65 歳以上の年齢階
層別で解析)
3 価の高用量・標準用量ワクチン
における安全性評価
(高用量は筋肉内および皮下接種)
4 価の高用量・標準用量ワクチン
における安全性評価
(高用量は筋肉内接種、標準用量
は皮下接種)
DiazGrandos et al. (2014):海外第 3b/4 相試験(FIM12)
本研究では、接種後 6 か月〜8 か月の追跡期間において、重篤な有害事象(SAEs)を報告した HD-IIV3
群 1,323 例(8.3%)が、SD-IIV3 群 1,442 例(9.0%)と比較して統計的に有意に低い結果であった(相対リス
ク 0.92 [95%CI: 0.85, 0.9]。HD-IIV3 群において、ワクチンとの因果関係が否定されなかった SAE は 3
例(第 7 脳神経麻痺、循環血液量減少性ショック、急性散在性脳脊髄炎)あったが、いずれも臨床試験終了
前に回復した。死亡例の報告数も両群で同程度であった(HD-IIV3 群 83 例, 0.5% vs SD-IIV3 群 84 例,
0.5%)。注目すべき有害事象(AESI)であるギラン・バレ症候群(GBS)が、SD-IIV3 群(15,991 例)で 1 例報
告された 65。第 6 脳神経麻痺が HD-IIV3 群で 1 例、SD-IIV3 群で 5 例と報告されたが、ワクチンとの因
果関係は否定されている。急性散在性脳脊髄炎(ADEM)を含む脳炎や脊髄炎も HD-IIV3 群(15,992 例)に
て 5 例(脳炎 4 例、ADEM1 例)がみとめられ、接種後 117 日後に発生した ADEM1 例は、重篤であり、
ワクチンとの因果関係は否定されなかった 65,66。また、HD-IIV3 群にて 1 例のスティーヴンス・ジョン
ソン症候群(SJS)が重篤例として報告されているが、ワクチンとの因果関係は否定された。
Chang et al. (2019):海外第3相試験(QHD13)
本研究では異なる B 型系統も比較しており、HD-IIV3-1 はビクトリア系統、HD-IIV3-2 は山形系統、
HD-IIV4 は両系統を含んでいた。安全性解析は、HD-IIV3 の両群を統合した集団(統合 HD-IIV3 群)で
行っている場合もある。接種後 30 分以内に報告された非特定有害事象は、HD-IIV4 群で 7 例(注射部位
25