よむ、つかう、まなぶ。
03資料1-1森野委員提出資料(高齢者に対するインフルエンザワクチンファクトシート) (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64997.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第32回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
するインフルエンザワクチンが定期接種化された。2013 年に経鼻投与ワクチン等の改良されたインフル
エンザワクチンが、開発優先度が高いワクチンに位置付けられた。2023 年 3 月に、経鼻弱毒生インフル
エンザワクチンが若年者(2 歳から 19 歳未満)に対して製造販売承認された。2024 年 12 月に、高用量イ
ンフルエンザ HA ワクチンの 60 歳以上に対する使用について、製造販売承認された。
2025 年 7 月現在、日本で使用可能な高齢者に対するインフルエンザワクチンの効能・効果(承認事項)
は、インフルエンザの予防である。
(2) ワクチン製剤
インフルエンザワクチン株は、WHO インフルエンザワクチン構成諮問委員会により、次シーズンに対
するものが毎年 2 回(北半球用と南半球用 1 回ずつ)選定される。これまで日本においては、国立感染症
研究所で 1〜複数の製造候補株を順位付けして推薦し、厚生労働省が、国立感染症研究所の推薦および審
議会(株選定小委員会)での検討を踏まえて 1 つの製造株を選定し、国内のすべてのワクチン製造販売業
者は選定された製造株でワクチンを製造してきた。海外においては、WHO の推奨に基づいて、複数の製
造候補から各ワクチン製造会社が製造株を 1 つ選択して製造するという流れであり、輸入ワクチンであ
る高用量インフルエンザ HA ワクチンおよび、小児を対象とした経鼻弱毒生インフルエンザワクチンで
用いられるワクチン株と、日本で用いられている標準用量の不活化ワクチン株が異なる場合がある。2024
年、厚生労働省は国立感染症研究所の推薦株だけでなく、WHO 推奨のワクチン株のリストに含まれてい
るものであれば、日本においても使用可能との見解を示し 29、高用量インフルエンザ HA ワクチンを含
め、海外で製造されたインフルエンザワクチンが国内で使用可能となった。
WHO インフルエンザワクチン構成諮問委員会は、2024 年 2 月に発表された 2024/25 シーズンに北半
球で用いるインフルエンザワクチンの推奨構成として、2023 年9月以降に系統が特定された B 型株は全
てビクトリア系統であり、山形系統の自然感染は 2020 年3月以降確認されていないため、B 型山形系統
の抗原をインフルエンザワクチンに含める正当性は既に失われており、ワクチンから除外すべきという
見解を示した 30。製造販売業者での対応に要する期間等も踏まえ、2025/26 シーズンから、日本において
も、B型山形系統を除く「3価ワクチン」とすることになった 31。2025 年 5 月の小委員会において、A
型株 A/ビクトリア/4897/2022(IVR-238)(H1N1)・A/パース/722/2024(IVR-262)(H3N2)、B型株
B/オーストリア/1359417/2021(BVR-26)(ビクトリア系統)の 3 株を選定されている 32。
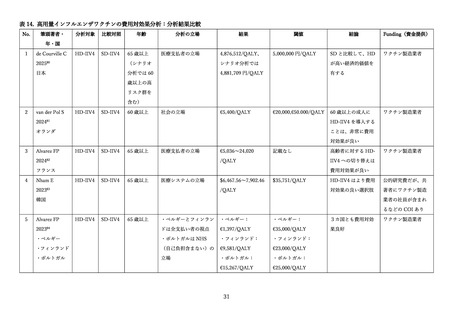
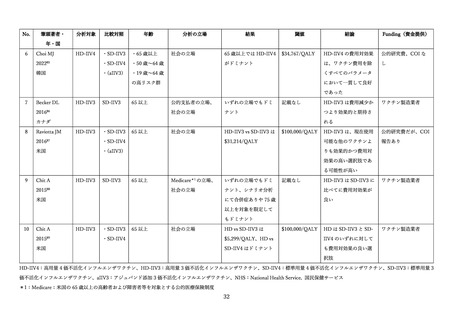
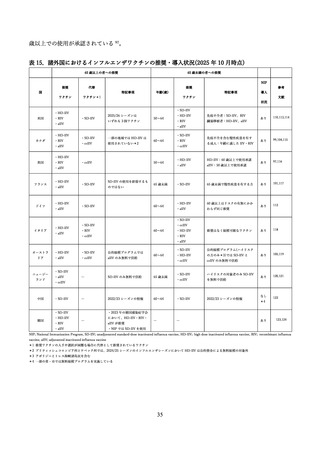
高齢者に対して、インフルエンザの予防を適応とし、2025 年 7 月現在、日本で製造販売承認されてい
るインフルエンザワクチンの特徴について表1にまとめた。
15
エンザワクチンが、開発優先度が高いワクチンに位置付けられた。2023 年 3 月に、経鼻弱毒生インフル
エンザワクチンが若年者(2 歳から 19 歳未満)に対して製造販売承認された。2024 年 12 月に、高用量イ
ンフルエンザ HA ワクチンの 60 歳以上に対する使用について、製造販売承認された。
2025 年 7 月現在、日本で使用可能な高齢者に対するインフルエンザワクチンの効能・効果(承認事項)
は、インフルエンザの予防である。
(2) ワクチン製剤
インフルエンザワクチン株は、WHO インフルエンザワクチン構成諮問委員会により、次シーズンに対
するものが毎年 2 回(北半球用と南半球用 1 回ずつ)選定される。これまで日本においては、国立感染症
研究所で 1〜複数の製造候補株を順位付けして推薦し、厚生労働省が、国立感染症研究所の推薦および審
議会(株選定小委員会)での検討を踏まえて 1 つの製造株を選定し、国内のすべてのワクチン製造販売業
者は選定された製造株でワクチンを製造してきた。海外においては、WHO の推奨に基づいて、複数の製
造候補から各ワクチン製造会社が製造株を 1 つ選択して製造するという流れであり、輸入ワクチンであ
る高用量インフルエンザ HA ワクチンおよび、小児を対象とした経鼻弱毒生インフルエンザワクチンで
用いられるワクチン株と、日本で用いられている標準用量の不活化ワクチン株が異なる場合がある。2024
年、厚生労働省は国立感染症研究所の推薦株だけでなく、WHO 推奨のワクチン株のリストに含まれてい
るものであれば、日本においても使用可能との見解を示し 29、高用量インフルエンザ HA ワクチンを含
め、海外で製造されたインフルエンザワクチンが国内で使用可能となった。
WHO インフルエンザワクチン構成諮問委員会は、2024 年 2 月に発表された 2024/25 シーズンに北半
球で用いるインフルエンザワクチンの推奨構成として、2023 年9月以降に系統が特定された B 型株は全
てビクトリア系統であり、山形系統の自然感染は 2020 年3月以降確認されていないため、B 型山形系統
の抗原をインフルエンザワクチンに含める正当性は既に失われており、ワクチンから除外すべきという
見解を示した 30。製造販売業者での対応に要する期間等も踏まえ、2025/26 シーズンから、日本において
も、B型山形系統を除く「3価ワクチン」とすることになった 31。2025 年 5 月の小委員会において、A
型株 A/ビクトリア/4897/2022(IVR-238)(H1N1)・A/パース/722/2024(IVR-262)(H3N2)、B型株
B/オーストリア/1359417/2021(BVR-26)(ビクトリア系統)の 3 株を選定されている 32。
高齢者に対して、インフルエンザの予防を適応とし、2025 年 7 月現在、日本で製造販売承認されてい
るインフルエンザワクチンの特徴について表1にまとめた。
15