資料1-2-3-2 薬機法に基づく製造販売業者からの副反応疑い報告状況について(スパイクバックス筋注・集計対象期間における基礎疾患等及び症例経過) (105 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00052.html |
| 出典情報 | 第85回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第14回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(10/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
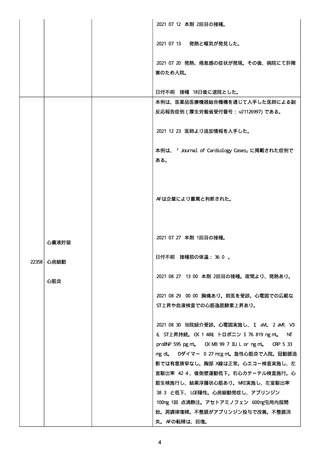
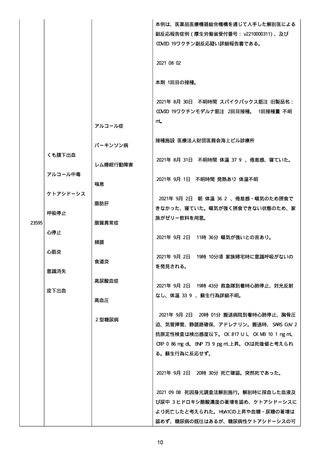
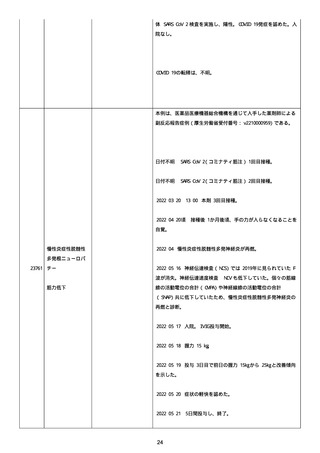
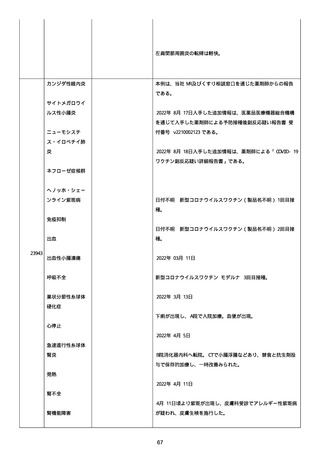
防接種後副反応疑い報告書(受付番号:v2210001912)である。
接種時年齢:58 歳 3 か月
予診票での留意点(基礎疾患、アレルギー、最近 1 ヶ月以内のワ
クチン接種や病気、服薬中の薬、過去の副作用歴、発育状況
等):無
COVID-19 の罹患歴:なし。
ヘパリンの投与歴:なし。
血栓のリスクとなる因子:なし。
除外した疾患:なし。
塞栓症;
24040
併用薬は報告者から報告されなかった。
急性心筋梗塞;
血栓症
2021 年 07 月 05 日
本剤 1 回目接種。
2021 年 07 月 06 日
胸痛出現した。
2021 年 07 月 07 日
入院、当院受診し急性心筋梗塞の診断。
(初回検査)
SARS-CoV-2 検査:陰性
NEAR 法。
血算:未実施。
抗血小板第 4 因子抗体(抗 PF4 抗体):未実施。
105