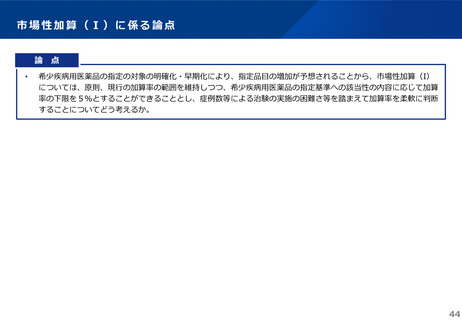
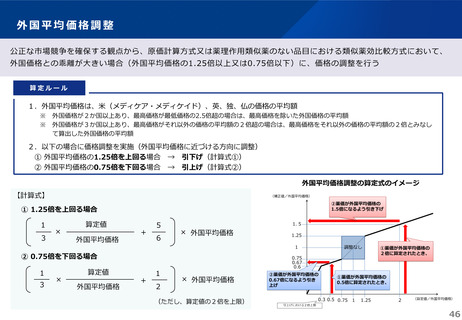
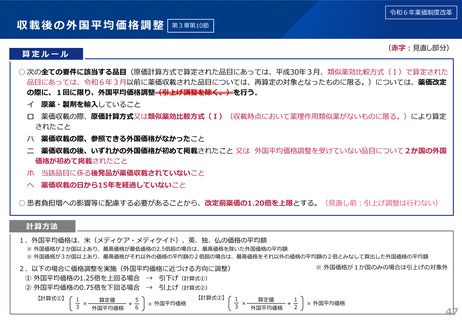
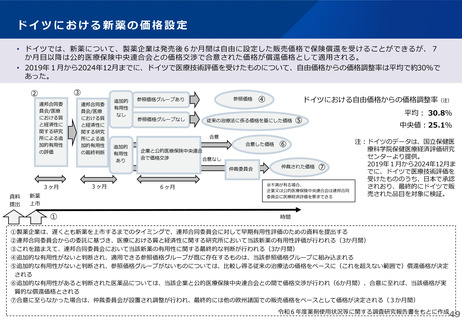
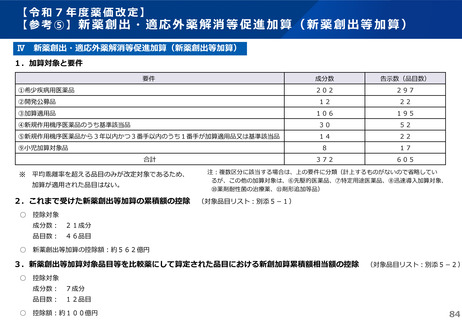
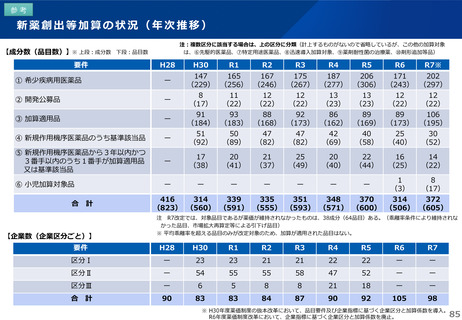
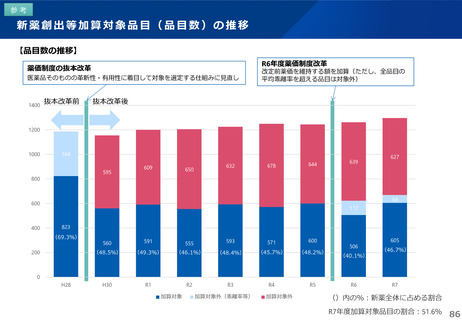
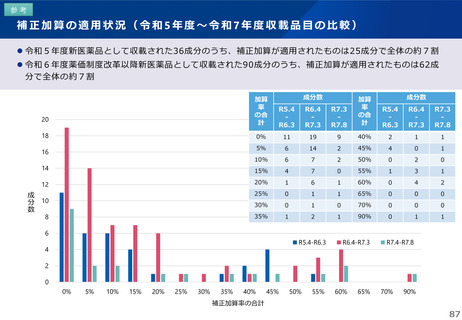
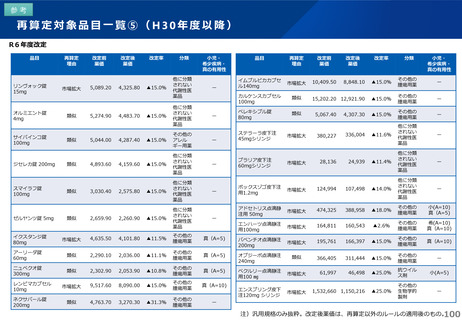
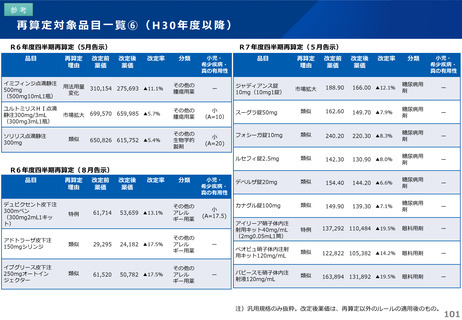
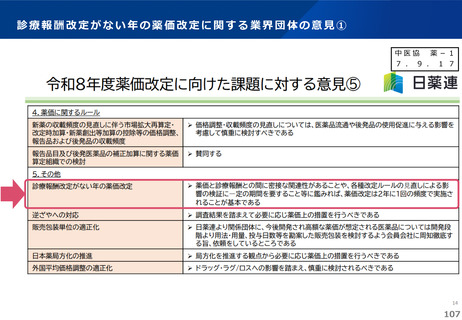
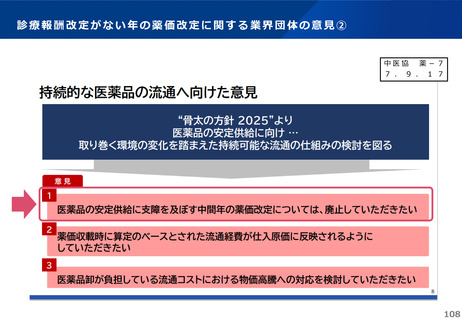
薬-1令和8年度薬価改定について➄ (32 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_66037.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第241回 11/19)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
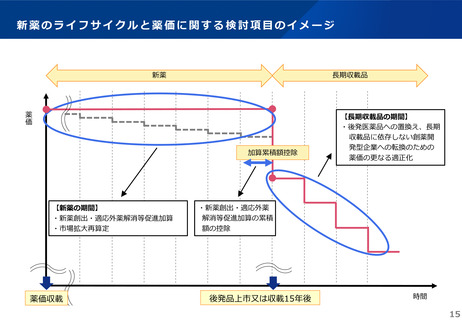
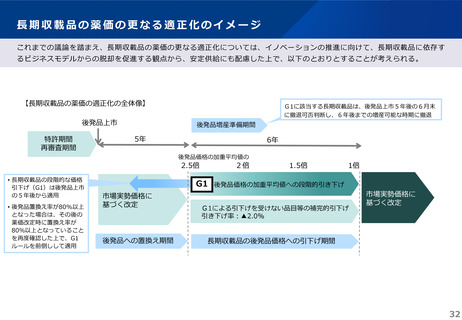
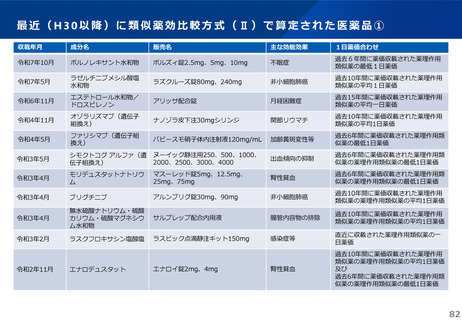
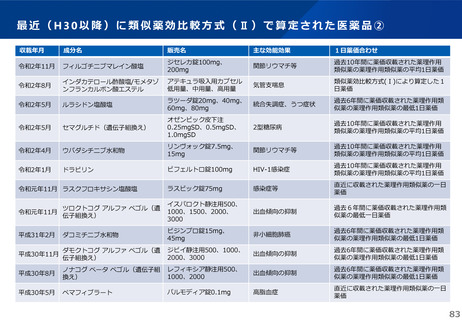
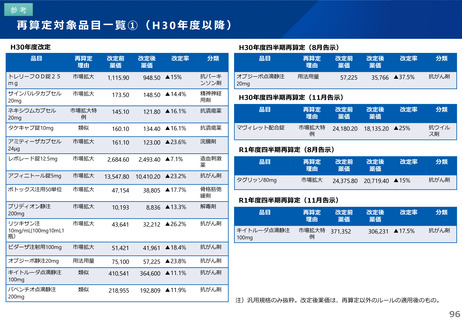
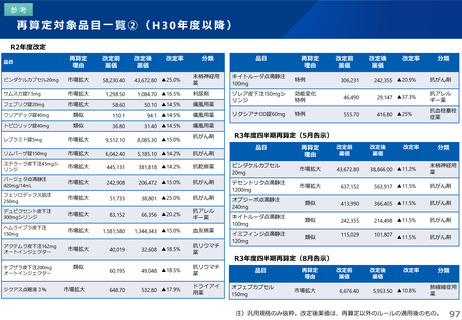
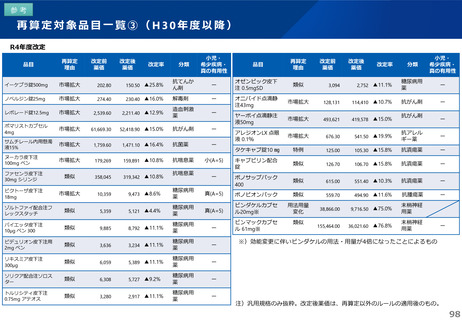
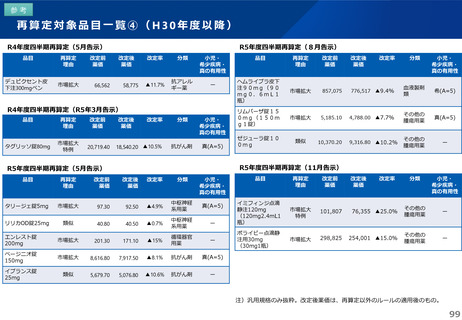
これまでの議論を踏まえ、長期収載品の薬価の更なる適正化については、イノベーションの推進に向けて、長期収載品に依存す
るビジネスモデルからの脱却を促進する観点から、安定供給にも配慮した上で、以下のとおりとすることが考えられる。
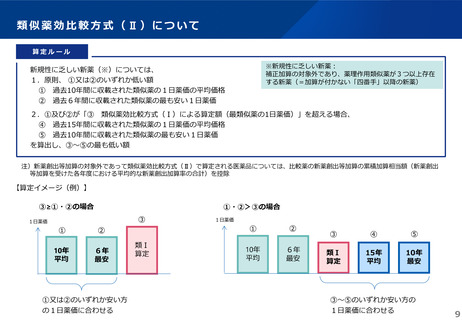
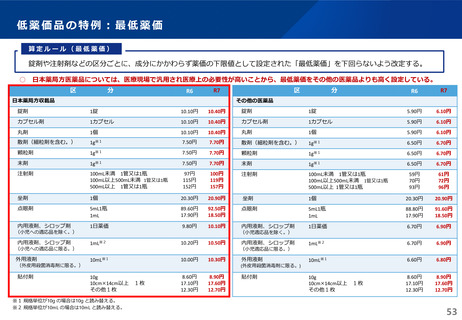
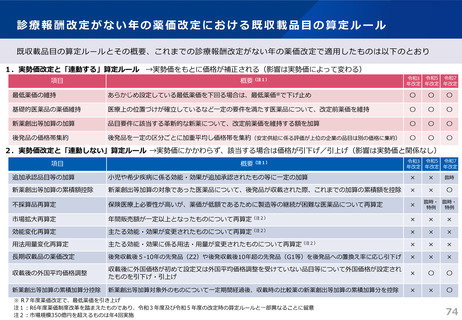
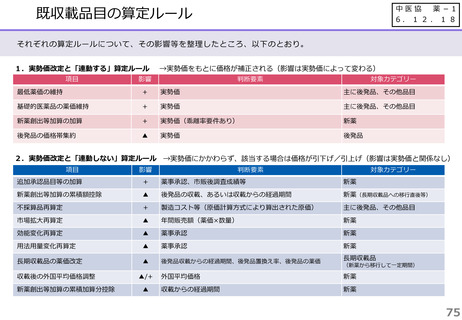
【長期収載品の薬価の適正化の全体像】
後発品上市
特許期間
再審査期間
G1に該当する長期収載品は、後発品上市5年後の6月末
に撤退可否判断し、6年後までの増産可能な時期に撤退
後発品増産準備期間
5年
6年
後発品価格の加重平均値の
2.5倍
• 長期収載品の段階的な価格
引下げ(G1)は後発品上市
の5年後から適用
• 後発品置換え率が80%以上
となった場合は、その後の
薬価改定時に置換え率が
80%以上となっていること
を再度確認した上で、G1
ルールを前倒しして適用
2倍
G1
市場実勢価格に
基づく改定
後発品への置換え期間
1.5倍
1倍
後発品価格の加重平均値への段階的引き下げ
G1による引下げを受けない品目等の補完的引下げ
引き下げ率:▲2.0%
市場実勢価格に
基づく改定
長期収載品の後発品価格への引下げ期間
32