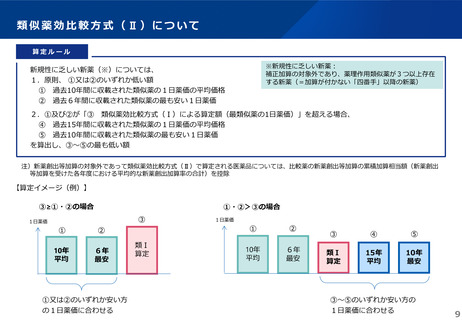
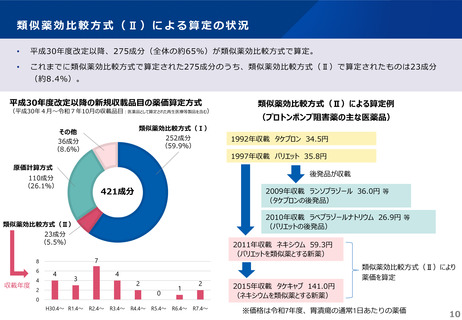
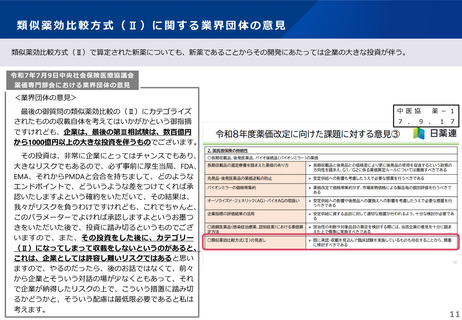
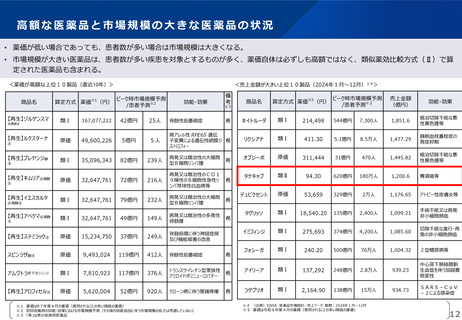
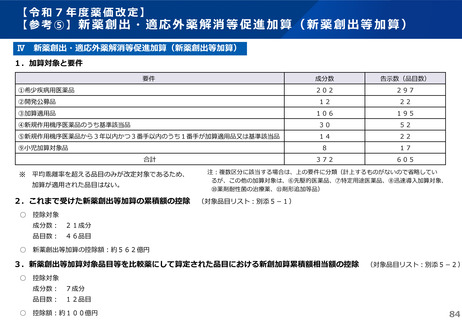
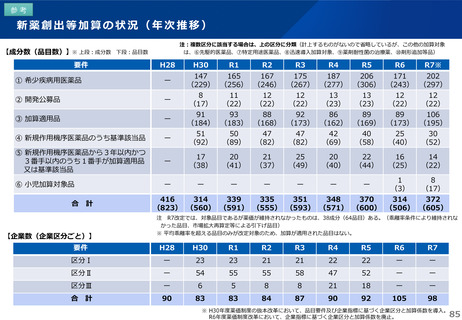
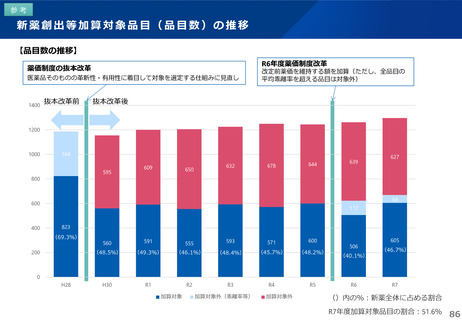
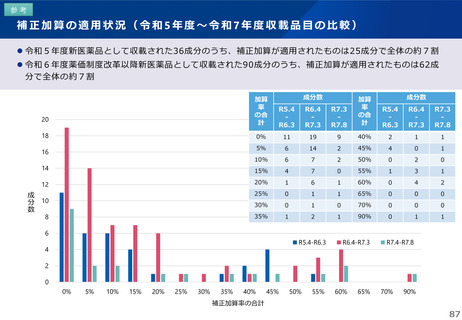
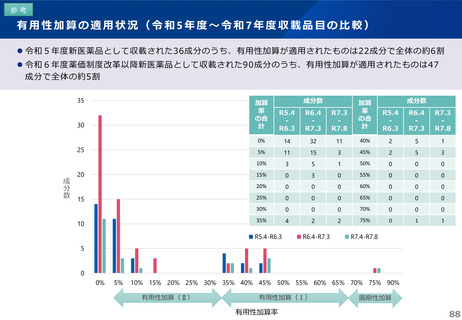
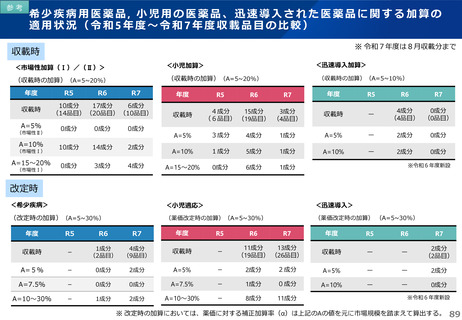
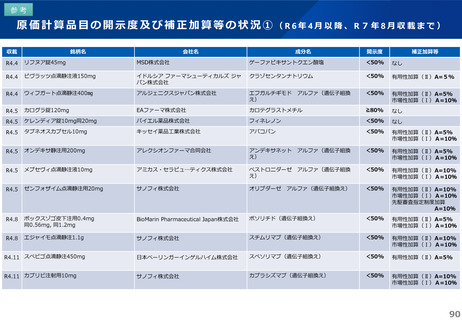
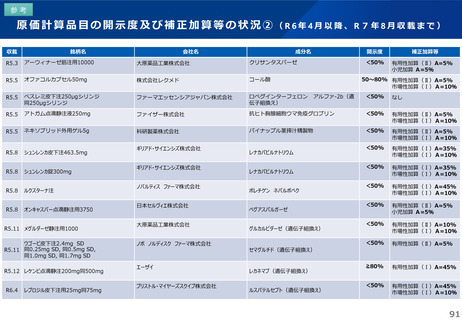
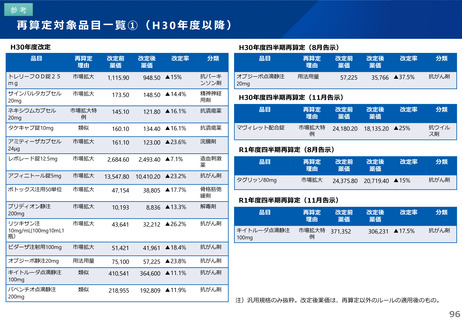
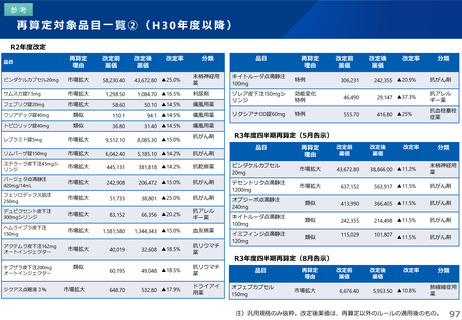
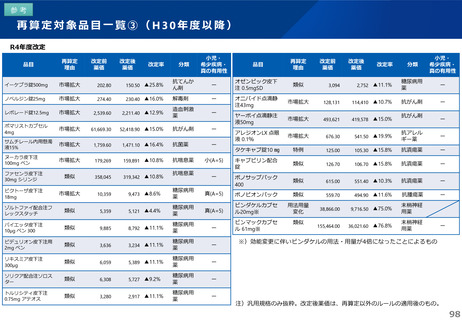
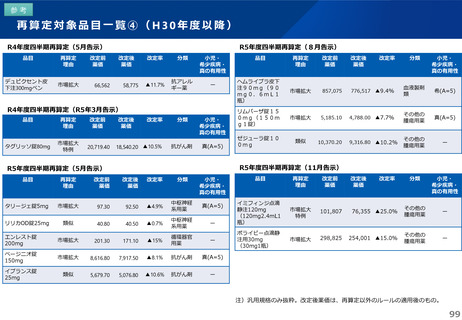
薬-1令和8年度薬価改定について➄ (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_66037.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第241回 11/19)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
10月8日に示した論点
イノベーションの評価と国民皆保険の持続性の確保を両立する観点から、以下の点についてどう考えるか。
<市場拡大再算定の類似品>
• 令和6年度薬価制度改⾰では、中央社会保険医療協議会であらかじめ特定した領域に該当する品目は類似品として取り扱わないこととしたこと
も踏まえ、市場拡大再算定の類似品についてどう考えるか。
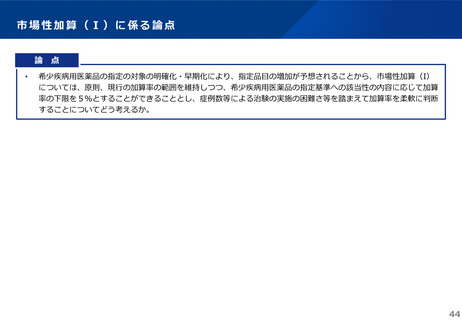
<希少疾患、小児の効能追加における市場拡大再算定>
• 小児、希少疾病のみ効能追加に対する市場拡大再算定の適用について、これまで柔軟な対応を⾏ってきたが、これについてどう考えるか。
これまでの主な意見
<市場拡大再算定の類似品>
• 現在のPD-1/PDL-1やJAK阻害のほかに、今後どのような事例が想定されるのか検討する必要がある。あわせて、類似品としての適用を除外する
領域について、基準あるいはルール設定が必要ではないか。
• 今後一定のルールを設けた中で、どういうものを扱うのかということを検討すべき。
• 除外する領域の追加を検討することに異論はないが、類似品自体は現段階では必要。市場規模拡大の基準についても、改めて検討する余地があ
る。個々の製品だけではなく、市場を分け合いながら領域全体を拡大する場合、あるいは単価が高い薬剤の対応等も課題である。
<希少疾患、小児の効能追加における市場拡大再算定>
• これまでの運用として、原則、小児希少疾病の効能等の追加のみをもって、市場拡大再算定の対象品目に該当とは判断していないとのことであ
れば、そうした実績をしっかりと公表していくべき。
【専門委員からの意見】
• 希少疾患、小児の効能追加における市場拡大再算定については、使用実態が著しく変化した既収載品には該当しないという旨を明確化すること
で、企業にとっては予見性が高まり、希少疾患、小児のさらなる開発を促進することにつながる。
【関係業界の主な意見】
<市場拡大再算定の類似品>
• 他社品の売上規模など外的要因により発生するものであり、薬価の予見性を著しく損なう要因となるため、廃止すべき。
<希少疾患、小児の効能追加における市場拡大再算定>
• 希少疾病や小児の効能追加のみならず、追加した効能・効果が市場に与える影響が明らかに小さい場合等については、対象から除外すべき。
23