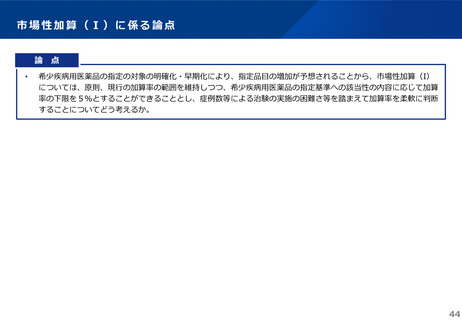
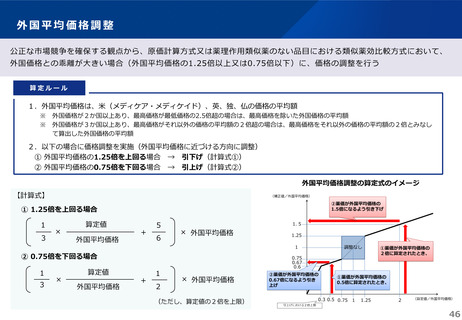
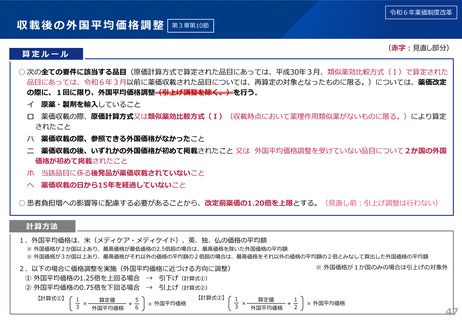
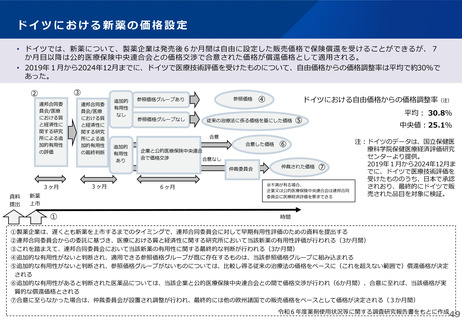
薬-1令和8年度薬価改定について➄ (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_66037.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第241回 11/19)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
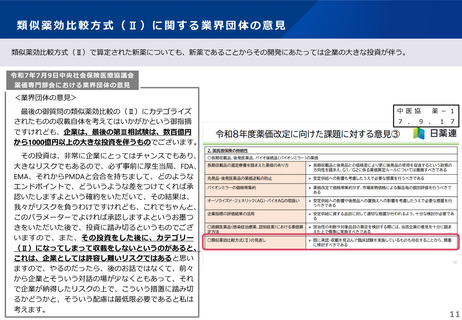
類似薬効比較方式(Ⅱ)で算定された新薬についても、新薬であることからその開発にあたっては企業の大きな投資が伴う。
令和7年7月9日中央社会保険医療協議会
薬価専門部会における業界団体の意見
<業界団体の意見>
最後の御質問の類似薬効比較の(Ⅱ)にカテゴライズ
されたものの収載自体を考えてはいかがかという御指摘
ですけれども、企業は、最後の第Ⅲ相試験は、数百億円
から1000億円以上の大きな投資を伴うものでございます。
その投資は、非常に企業にとってはチャンスでもあり、
大きなリスクでもあるので、必ず事前に厚生当局、FDA、
EMA、それからPMDAと会合を持ちまして、どのような
エンドポイントで、どういうような差をつけてくれば承
認いたしますよという確約をいただいて、その結果は、
我々がリスクを負うわけですけれども、これでちゃんと、
このパラメーターでよければ承認しますよというお墨つ
きをいただいた後で、投資に踏み切るというものでござ
いますので、また、その投資をした後に、カテゴリー
(Ⅱ)になってしまって収載をしないというのがあると、
これは、企業としては許容し難いリスクではあると思い
ますので、やるのだったら、後のお話ではなくて、前々
から企業とそういう対話の場が少なくともあって、それ
で企業が納得したリスクの上で、こういう措置に踏み切
るかどうかと、そういう配慮は最低限必要であると私は
考えます。
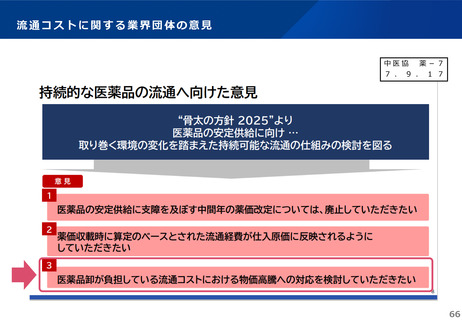
中医協
薬-1
7 . 9 . 1 7
11