よむ、つかう、まなぶ。
10参考資料1-2 成人用肺炎球菌ワクチンファクトシート[4.9MB] (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_70339.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第64回 2/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
法も有用である 45 59 60,61。また、肺炎球菌ワクチンの免疫誘導能や肺炎球菌感染症に罹患した患者の液性
免疫を評価するための enzyme-linked immunosorbent assay(ELISA)法による血清型特異 IgG 濃度の測
定や、multiplexed opsonophagocytic killing assay(MOPA)による血清型特異的な殺菌活性の測定も可能
である 62。
⑤ 治療法
米国 Clinical and Laboratory Standards Institute (CLSI) の基準 63 で判定する場合、日本国内の肺炎、
菌血症など髄膜炎以外の症例から分離される肺炎球菌の 99% 以上がペニシリン感受性であるため、ペニ
シリン系抗菌薬が第一選択薬となる 64,65。髄膜炎ではセフォタキシムおよびカルバペネム低感受性肺炎球
菌が分離されることから、薬剤感受性結果が得られるまではセフォタキシムまたはセフトリアキソンと
バンコマイシンの併用投与を行う 66,67。
⑥ 鑑別を要する他の疾患
鑑別を必要とする疾患に、他の呼吸器病原性細菌による肺炎をはじめとする呼吸器感染症、他の細菌に
起因する副鼻腔炎、中耳炎、菌血症、髄膜炎などがある。鑑別診断には起因菌の分離同定、遺伝子解析な
どの実験室診断を実施する必要がある。
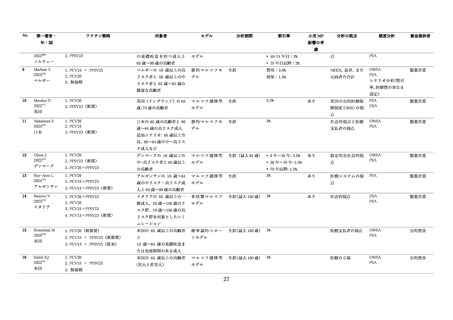
(2)肺炎球菌ワクチン導入の経緯
わが国において、23 価肺炎球菌莢膜ポリサッカライドワクチン(PPSV23)は 1988 年 3 月に薬事承認
され、1992 年 8 月に「脾摘患者における肺炎球菌による感染症の発症予防」について健康保険適用が認
められた。2006 年には PPSV23 はニューモバックス NP として製造販売承認され、2014 年 10 月から 65
歳以上の成人等を対象として定期接種ワクチン(B 類疾病)となった。
2010 年 11 月に「子宮頸がん等ワクチン接種緊急促進事業」が始まり、5 歳未満の小児に対する沈降 7
価肺炎球菌結合型ワクチン(PCV7)接種の公費助成が拡充された。その後、PCV7 は 2013 年 4 月から
小児の定期接種ワクチンとなった。2013 年 6 月に沈降 13 価肺炎球菌結合型ワクチン(PCV13)が製造
販売承認され、同年 11 月には小児の定期接種ワクチンは PCV13 に置き換わった。2014 年 6 月には 65
歳以上の成人にも PCV13 の適応が拡大され、さらに 2022 年 9 月には沈降 15 価肺炎球菌結合型ワクチ
ン(PCV15)が製造販売承認、2023 年 4 月から 65 歳以上の成人を含むハイリスク者を対象として任意
接種が可能となった。2023 年 6 月からは小児にも PCV15 の適応が拡大され、2024 年 4 月からは小児の
定期接種ワクチンに追加された。その後、2024 年3月には沈降 20 価肺炎球菌結合型ワクチン(PCV20)
が小児を対象に製造販売承認され、同年8月には 65 歳以上の成人を含むハイリスク者に適応が拡大され
た。PCV20 は 2024 年 10 月に小児の定期接種ワクチンに追加された。なお、PCV20 の供給に併せて、
PCV13 の供給は終了した。
(3)国内の疫学状況(及び諸外国の状況、国内との比較)
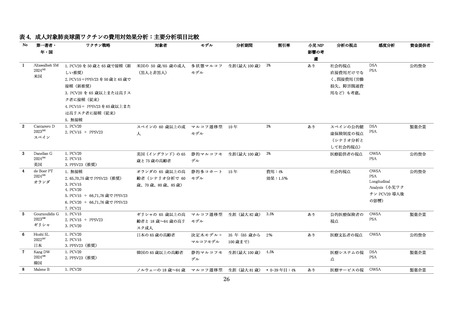
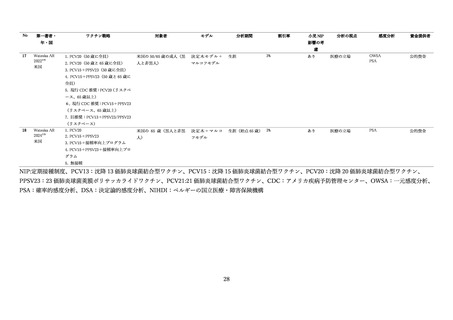
① 肺炎球菌結合型ワクチンの直接効果と間接効果
欧米諸国においては、小児への PCV7 の定期接種導入により肺炎球菌感染症の疾病負荷の有意な減少
が報告された 68 。一方で、非ワクチン型血清型による IPD 罹患率が増加し、血清型置換(serotype
replacement)が観察されるようになった 69,70。小児の PCV10/PCV13 接種を導入した世界各国でも、導
10
免疫を評価するための enzyme-linked immunosorbent assay(ELISA)法による血清型特異 IgG 濃度の測
定や、multiplexed opsonophagocytic killing assay(MOPA)による血清型特異的な殺菌活性の測定も可能
である 62。
⑤ 治療法
米国 Clinical and Laboratory Standards Institute (CLSI) の基準 63 で判定する場合、日本国内の肺炎、
菌血症など髄膜炎以外の症例から分離される肺炎球菌の 99% 以上がペニシリン感受性であるため、ペニ
シリン系抗菌薬が第一選択薬となる 64,65。髄膜炎ではセフォタキシムおよびカルバペネム低感受性肺炎球
菌が分離されることから、薬剤感受性結果が得られるまではセフォタキシムまたはセフトリアキソンと
バンコマイシンの併用投与を行う 66,67。
⑥ 鑑別を要する他の疾患
鑑別を必要とする疾患に、他の呼吸器病原性細菌による肺炎をはじめとする呼吸器感染症、他の細菌に
起因する副鼻腔炎、中耳炎、菌血症、髄膜炎などがある。鑑別診断には起因菌の分離同定、遺伝子解析な
どの実験室診断を実施する必要がある。
(2)肺炎球菌ワクチン導入の経緯
わが国において、23 価肺炎球菌莢膜ポリサッカライドワクチン(PPSV23)は 1988 年 3 月に薬事承認
され、1992 年 8 月に「脾摘患者における肺炎球菌による感染症の発症予防」について健康保険適用が認
められた。2006 年には PPSV23 はニューモバックス NP として製造販売承認され、2014 年 10 月から 65
歳以上の成人等を対象として定期接種ワクチン(B 類疾病)となった。
2010 年 11 月に「子宮頸がん等ワクチン接種緊急促進事業」が始まり、5 歳未満の小児に対する沈降 7
価肺炎球菌結合型ワクチン(PCV7)接種の公費助成が拡充された。その後、PCV7 は 2013 年 4 月から
小児の定期接種ワクチンとなった。2013 年 6 月に沈降 13 価肺炎球菌結合型ワクチン(PCV13)が製造
販売承認され、同年 11 月には小児の定期接種ワクチンは PCV13 に置き換わった。2014 年 6 月には 65
歳以上の成人にも PCV13 の適応が拡大され、さらに 2022 年 9 月には沈降 15 価肺炎球菌結合型ワクチ
ン(PCV15)が製造販売承認、2023 年 4 月から 65 歳以上の成人を含むハイリスク者を対象として任意
接種が可能となった。2023 年 6 月からは小児にも PCV15 の適応が拡大され、2024 年 4 月からは小児の
定期接種ワクチンに追加された。その後、2024 年3月には沈降 20 価肺炎球菌結合型ワクチン(PCV20)
が小児を対象に製造販売承認され、同年8月には 65 歳以上の成人を含むハイリスク者に適応が拡大され
た。PCV20 は 2024 年 10 月に小児の定期接種ワクチンに追加された。なお、PCV20 の供給に併せて、
PCV13 の供給は終了した。
(3)国内の疫学状況(及び諸外国の状況、国内との比較)
① 肺炎球菌結合型ワクチンの直接効果と間接効果
欧米諸国においては、小児への PCV7 の定期接種導入により肺炎球菌感染症の疾病負荷の有意な減少
が報告された 68 。一方で、非ワクチン型血清型による IPD 罹患率が増加し、血清型置換(serotype
replacement)が観察されるようになった 69,70。小児の PCV10/PCV13 接種を導入した世界各国でも、導
10