よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
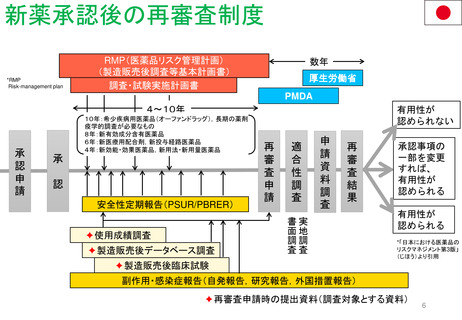
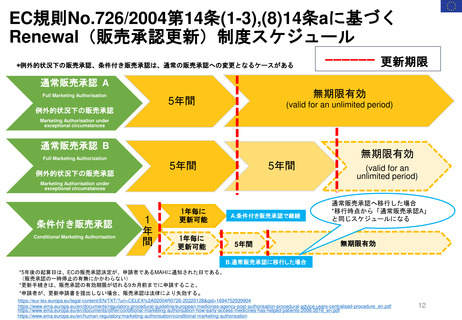
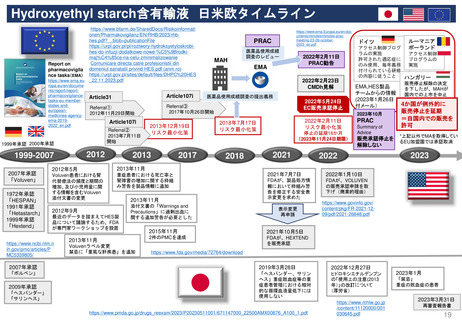
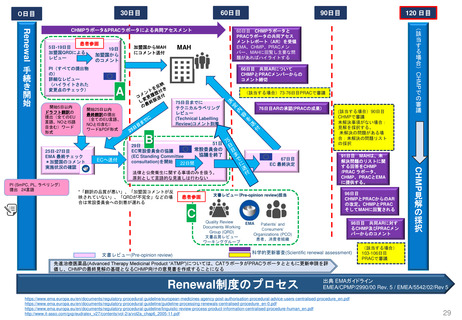
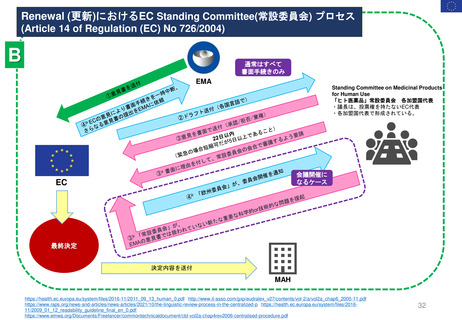
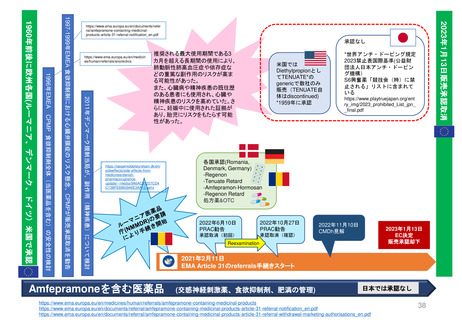
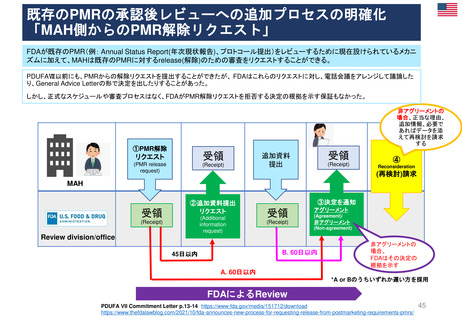
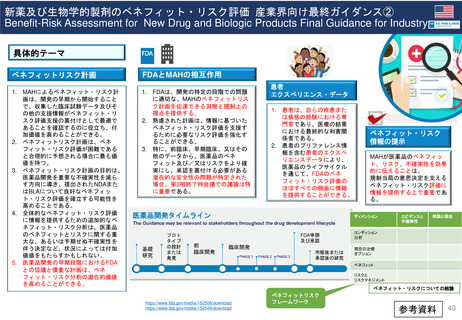
新薬承認後の再審査制度
*RMP
Risk-management plan
数年
RMP(医薬品リスク管理計画)
(製造販売後調査等基本計画書)
調査・試験実施計画書
厚生労働省
PMDA
4~10年
承
認
申
請
10年:希少疾病用医薬品(オーファンドラッグ),長期の薬剤
疫学的調査が必要なもの
8年:新有効成分含有医薬品
6年:新医療用配合剤,新投与経路医薬品
4年:新効能・効果医薬品,新用法・新用量医薬品
承
認
安全性定期報告(PSUR/PBRER)
✦使用成績調査
✦製造販売後データベース調査
有用性が
認められない
再
審
査
申
請
適
合
性
調
査
申
請
資
料
調
査
再
審
査
結
果
書実
面地
調調
査査
承認事項の
一部を変更
すれば、
有用性が
認められる
有用性が
認められる
*「日本における医薬品の
リスクマネジメント第3版」
(じほう)より引用
✦製造販売後臨床試験
副作用・感染症報告(自発報告,研究報告,外国措置報告)
✦再審査申請時の提出資料(調査対象とする資料)
6
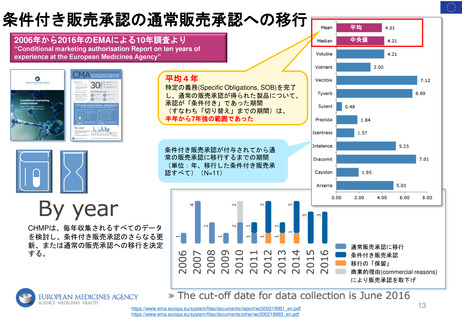
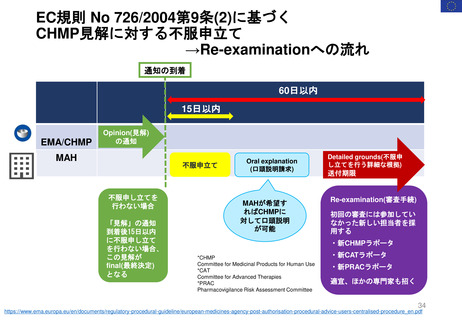
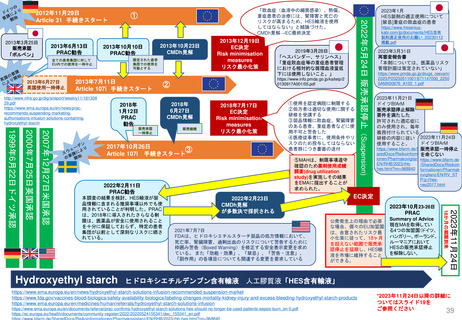
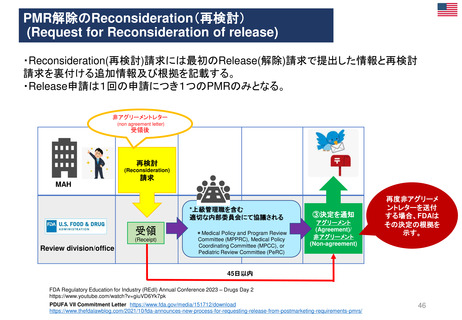
*RMP
Risk-management plan
数年
RMP(医薬品リスク管理計画)
(製造販売後調査等基本計画書)
調査・試験実施計画書
厚生労働省
PMDA
4~10年
承
認
申
請
10年:希少疾病用医薬品(オーファンドラッグ),長期の薬剤
疫学的調査が必要なもの
8年:新有効成分含有医薬品
6年:新医療用配合剤,新投与経路医薬品
4年:新効能・効果医薬品,新用法・新用量医薬品
承
認
安全性定期報告(PSUR/PBRER)
✦使用成績調査
✦製造販売後データベース調査
有用性が
認められない
再
審
査
申
請
適
合
性
調
査
申
請
資
料
調
査
再
審
査
結
果
書実
面地
調調
査査
承認事項の
一部を変更
すれば、
有用性が
認められる
有用性が
認められる
*「日本における医薬品の
リスクマネジメント第3版」
(じほう)より引用
✦製造販売後臨床試験
副作用・感染症報告(自発報告,研究報告,外国措置報告)
✦再審査申請時の提出資料(調査対象とする資料)
6