よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
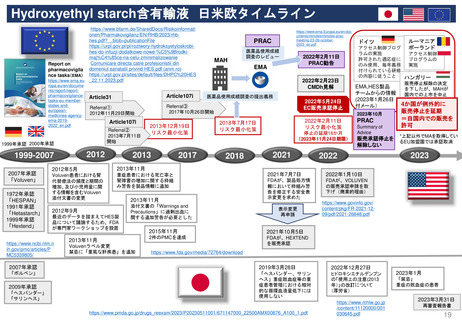
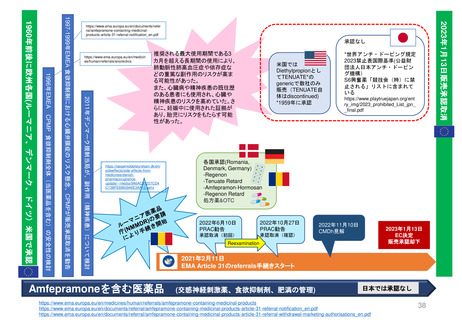
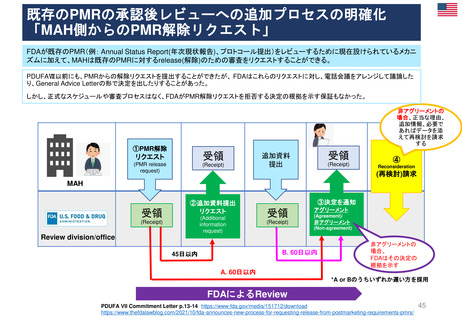
日本の再審査及び再評価制度に相当する制度の有無
欧 州
日 本
米 国
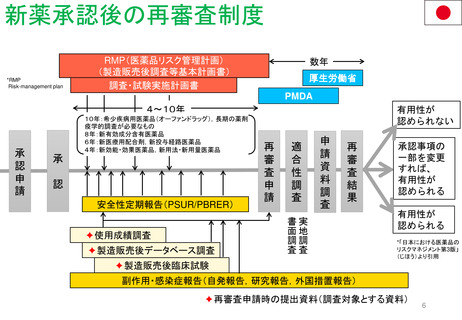
再審査制度 (1980年~)
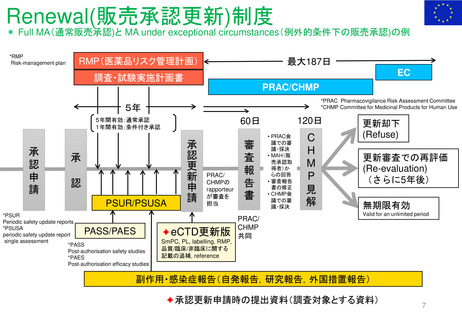
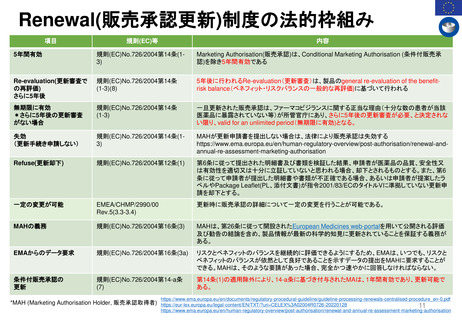
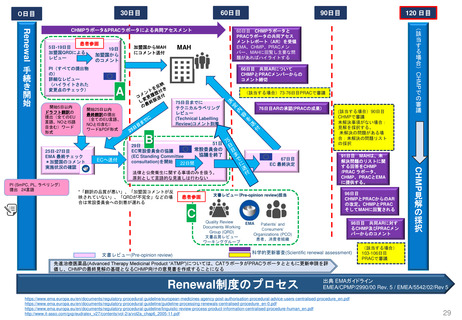
Renewal(承認更新)制度 (2004年3月~) すべての医薬品を対象とした制度はない
承認から一定期間後に有効性/安全性/品質を再確認
• 4年後 ‥ 新効能・効果/新用法・新用量の医薬品
• 6年後‥ 新医療用配合剤/新投与経路
• 8年後‥ 新有効成分含有
• 10年後‥ 希少疾患用/長期薬剤疫学的調査が必要
承認から一定期間後に有効性/安全性/品質を再確認
• 5年後 ‥ 通常承認
• 1年毎 ‥ 条件付き承認
• FDAが必要に応じて個別に対応している
無×
有〇
再評価制度 (1971年~)
一定期間に承認されたすべての医薬品を DESI(Drug Efficacy Study Implementation:
対象とした制度はない
薬効再評価の実施)制度 (1962年~)
承認後の医学・薬学の進歩に対応して、医薬品の有効
性/安全性/品質を見直す制度
• すべての医薬品が対象
• 各国審査方式で承認された医薬品も
中央審査方式で承認された医薬品と
同様の手続き(Referral)による評価を受ける
有△
無 × • 1938年~1962年に安全性のみを評価
して承認されたすべての医薬品の
有効性を検討
一定期間のみ実施
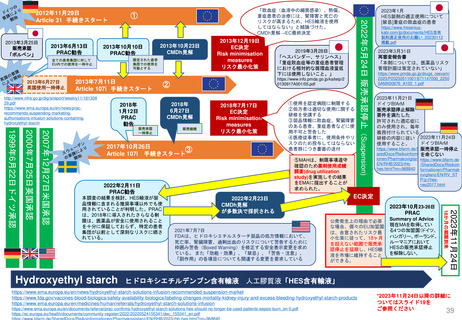
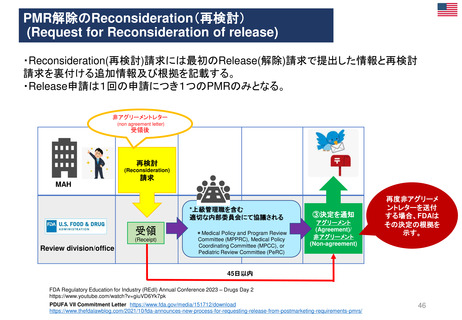
日本の再審査申請時に必要な調査に類似の市販後調査
日 本
欧 州
(強化モニタリング対象医薬品) (2012年7月~)
Postmarket Drug and Biologic
Safety Evaluations制度
• 新規承認医薬品に▼のマークが付され、集中的な安全
性モニタリングを行う。原則として新規有効成分含有医
薬品が対象
(市販後医薬品安全性評価)
(2007~2017年の一時期のみ実施)
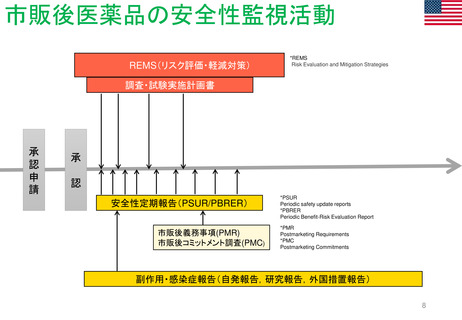
PASS(市販後安全性研究)
PAES(市販後有効性研究)
PMR(市販後義務事項)
PMC(市販後コミットメント調査)
(2010年9月~)
(1990年代~、2007年FDA改正法にて制度変更)
Black Triangle Scheme制度
使用成績調査
製造販売後データベース調査
製造販売後臨床試験
米 国
https://www.ema.europa.eu/en/human-regulatory-overview/post-authorisation/renewal-and-annual-re-assessment-marketing-authorisation
https://www.fda.gov/drugs/enforcement-activities-fda/drug-efficacy-study-implementation-desi
https://www.ema.europa.eu/en/human-regulatory-overview/post-authorisation/pharmacovigilance-post-authorisation/medicines-under-additional-monitoring
https://www.fda.gov/drugs/postmarket-requirements-and-commitments/postmarketing-requirements-and-commitments-reports
https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2010:348:0001:0016:EN:PDF
https://www.pmda.go.jp/int-activities/outline/0012.html
5
欧 州
日 本
米 国
再審査制度 (1980年~)
Renewal(承認更新)制度 (2004年3月~) すべての医薬品を対象とした制度はない
承認から一定期間後に有効性/安全性/品質を再確認
• 4年後 ‥ 新効能・効果/新用法・新用量の医薬品
• 6年後‥ 新医療用配合剤/新投与経路
• 8年後‥ 新有効成分含有
• 10年後‥ 希少疾患用/長期薬剤疫学的調査が必要
承認から一定期間後に有効性/安全性/品質を再確認
• 5年後 ‥ 通常承認
• 1年毎 ‥ 条件付き承認
• FDAが必要に応じて個別に対応している
無×
有〇
再評価制度 (1971年~)
一定期間に承認されたすべての医薬品を DESI(Drug Efficacy Study Implementation:
対象とした制度はない
薬効再評価の実施)制度 (1962年~)
承認後の医学・薬学の進歩に対応して、医薬品の有効
性/安全性/品質を見直す制度
• すべての医薬品が対象
• 各国審査方式で承認された医薬品も
中央審査方式で承認された医薬品と
同様の手続き(Referral)による評価を受ける
有△
無 × • 1938年~1962年に安全性のみを評価
して承認されたすべての医薬品の
有効性を検討
一定期間のみ実施
日本の再審査申請時に必要な調査に類似の市販後調査
日 本
欧 州
(強化モニタリング対象医薬品) (2012年7月~)
Postmarket Drug and Biologic
Safety Evaluations制度
• 新規承認医薬品に▼のマークが付され、集中的な安全
性モニタリングを行う。原則として新規有効成分含有医
薬品が対象
(市販後医薬品安全性評価)
(2007~2017年の一時期のみ実施)
PASS(市販後安全性研究)
PAES(市販後有効性研究)
PMR(市販後義務事項)
PMC(市販後コミットメント調査)
(2010年9月~)
(1990年代~、2007年FDA改正法にて制度変更)
Black Triangle Scheme制度
使用成績調査
製造販売後データベース調査
製造販売後臨床試験
米 国
https://www.ema.europa.eu/en/human-regulatory-overview/post-authorisation/renewal-and-annual-re-assessment-marketing-authorisation
https://www.fda.gov/drugs/enforcement-activities-fda/drug-efficacy-study-implementation-desi
https://www.ema.europa.eu/en/human-regulatory-overview/post-authorisation/pharmacovigilance-post-authorisation/medicines-under-additional-monitoring
https://www.fda.gov/drugs/postmarket-requirements-and-commitments/postmarketing-requirements-and-commitments-reports
https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2010:348:0001:0016:EN:PDF
https://www.pmda.go.jp/int-activities/outline/0012.html
5