よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
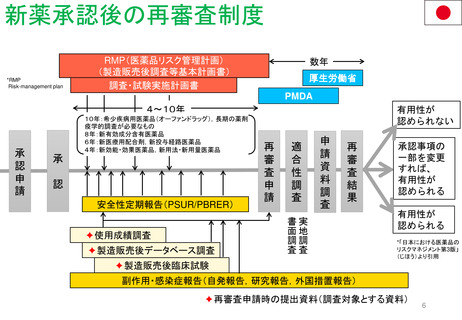
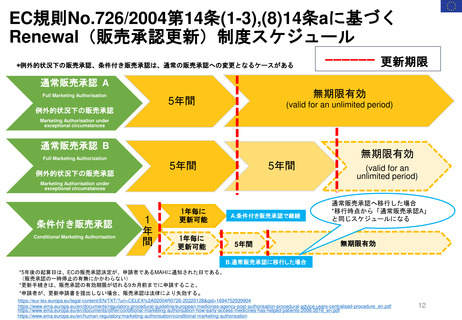
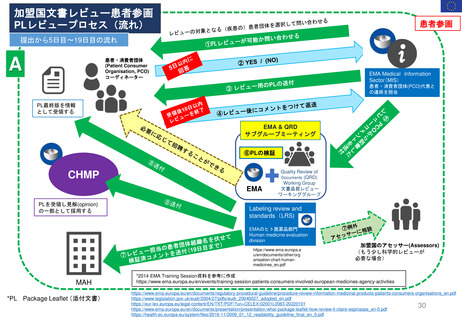
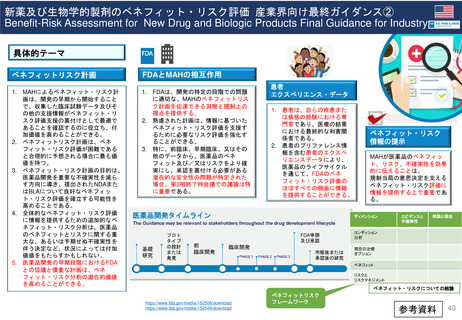
患者参画PL関連プロセス(詳細)
患者参画
患者団体によるPLレビューに求められること
A
医薬品の適応等により、
有資格団体から患者団体を選定
1. 情報が明確で理解しやすいものであることを確認すること。
2. 不明確な情報、不足している情報について、もしあればその質問をすること。
3. 医薬品をより安全に使用するために、患者向けの情報を改善すること。
SmPCとPLを送付
結論
EMA
LRS部門
PLのレビューにおける患者
の独自の洞察は、その読み
やすさを向上させ、科学的
議論を刺激した。
(Labeling review and standards)
レビュー後10日以内に返却
レビュー内容を
検証しMAHに
(アセッサへ送る場
合もあり)送付する。
*レビューを担当し
た患者単体名は伏せ
る。
PLユーザーテストについて
患者団体代表者
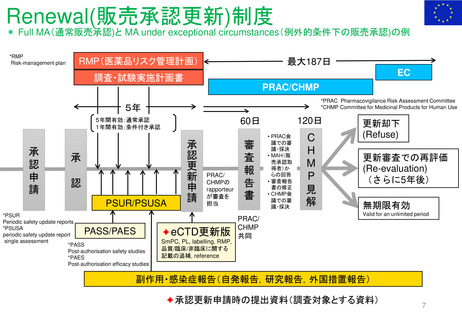
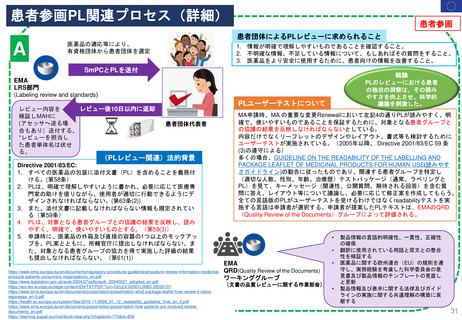
(PLレビュー関連)法的背景
Directive 2001/83/EC:
1. すべての医薬品の包装に添付文書(PL)を含めることを義務付
ける。(第58条)
2. PLは、明確で理解しやすいように書かれ、必要に応じて医療専
門家の助けを借りながら、使用者が適切に行動できるようにデ
ザインされなければならない。(第63条(2))
3. また、添付文書に記載しなければならない情報も規定されてい
る(第59条)
4. PLは、対象となる患者グループとの協議の結果を反映し、読み
やすく、明確で、使いやすいものとする。(第59(3))
5. 申請時に、医薬品の外箱及び直接の容器の1つ以上のモックアッ
プを、PL案とともに、所轄官庁に提出しなければならない。ま
た、対象となる患者グループの協力を得て実施した評価の結果
も提出しなければならない。(第61(1))
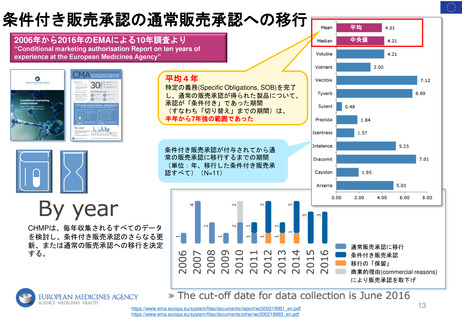
MA申請時、MA の重要な変更Renewalにおいて左記4の通りPLが読みやすく、明
確で、使いやすいものであることを保証するために、対象となる患者グループと
の協議の結果を反映しなければならないとしている。
内容だけでなくリーフレットのデザインやレイアウト、書式等も検討するために
ユーザーテストが実施されている。(2005年以降、 Directive 2001/83/EC 59 条
(3)の遵守による)
多くの場合、GUIDELINE ON THE READABILITY OF THE LABELLING AND
PACKAGE LEAFLET OF MEDICINAL PRODUCTS FOR HUMAN USE(読みやす
さガイドライン)の勧告に従ったものであり、関連する患者グループを特定し
(適切な人数、性別、年齢、治療歴)テストパッケージ(通常、ラベリングと
PL)を見て、キーメッセージ(関連性、公開質問、期待される回答)を含む質
問に答え、レイアウト等について議論し、必要に応じて修正案を作成してもらう。
全ての言語版のPLがユーザーテストを受けるわけではなくreadabilityテストを実
施する言語は申請者が選択する。申請者が提案したPLテキストは、EMAのQRD
(Quality Review of the Documents)グループによって評価される。
•
•
EMA
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/procedure-review-information-medicinal- QRD(Quality Review of the Documents)
products-patients-consumers-organisations_en.pdf
ワーキンググループ
https://www.legislation.gov.uk/eudr/2004/27/pdfs/eudr_20040027_adopted_en.pdf
•
https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:02001L0083-20220101
https://www.ema.europa.eu/en/documents/presentation/presentation-what-package-leaflet-how-review-it-claireespinasse_en-0.pdf
https://health.ec.europa.eu/system/files/2016-11/2009_01_12_readability_guideline_final_en_0.pdf
https://www.ema.europa.eu/en/documents/presentation/presentation-how-patients-are-involved-reviewdocuments_en.pdf
https://learning.eupati.eu/mod/book/view.php?chapterid=773&id=859
•
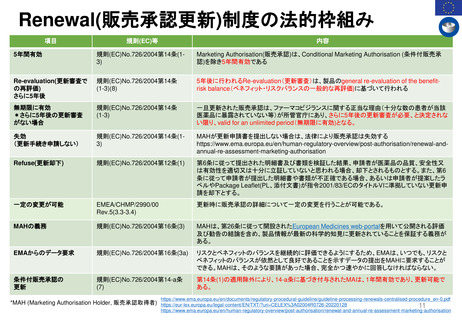
(文書の品質レビューに関する作業部会)
製品情報の言語的明確性、一貫性、正確性
の確保
翻訳に使用されている用語と原文との整合
性を検証する
医薬品に関する欧州連合(EU)の規則を遵
守し、実務経験を考慮した科学委員会の意
見書及び製品情報のテンプレートの見直し
と更新
製品情報及び表示に関する法律及びガイド
ラインの実施に関する共通理解の構築に貢
献する
31
患者参画
患者団体によるPLレビューに求められること
A
医薬品の適応等により、
有資格団体から患者団体を選定
1. 情報が明確で理解しやすいものであることを確認すること。
2. 不明確な情報、不足している情報について、もしあればその質問をすること。
3. 医薬品をより安全に使用するために、患者向けの情報を改善すること。
SmPCとPLを送付
結論
EMA
LRS部門
PLのレビューにおける患者
の独自の洞察は、その読み
やすさを向上させ、科学的
議論を刺激した。
(Labeling review and standards)
レビュー後10日以内に返却
レビュー内容を
検証しMAHに
(アセッサへ送る場
合もあり)送付する。
*レビューを担当し
た患者単体名は伏せ
る。
PLユーザーテストについて
患者団体代表者
(PLレビュー関連)法的背景
Directive 2001/83/EC:
1. すべての医薬品の包装に添付文書(PL)を含めることを義務付
ける。(第58条)
2. PLは、明確で理解しやすいように書かれ、必要に応じて医療専
門家の助けを借りながら、使用者が適切に行動できるようにデ
ザインされなければならない。(第63条(2))
3. また、添付文書に記載しなければならない情報も規定されてい
る(第59条)
4. PLは、対象となる患者グループとの協議の結果を反映し、読み
やすく、明確で、使いやすいものとする。(第59(3))
5. 申請時に、医薬品の外箱及び直接の容器の1つ以上のモックアッ
プを、PL案とともに、所轄官庁に提出しなければならない。ま
た、対象となる患者グループの協力を得て実施した評価の結果
も提出しなければならない。(第61(1))
MA申請時、MA の重要な変更Renewalにおいて左記4の通りPLが読みやすく、明
確で、使いやすいものであることを保証するために、対象となる患者グループと
の協議の結果を反映しなければならないとしている。
内容だけでなくリーフレットのデザインやレイアウト、書式等も検討するために
ユーザーテストが実施されている。(2005年以降、 Directive 2001/83/EC 59 条
(3)の遵守による)
多くの場合、GUIDELINE ON THE READABILITY OF THE LABELLING AND
PACKAGE LEAFLET OF MEDICINAL PRODUCTS FOR HUMAN USE(読みやす
さガイドライン)の勧告に従ったものであり、関連する患者グループを特定し
(適切な人数、性別、年齢、治療歴)テストパッケージ(通常、ラベリングと
PL)を見て、キーメッセージ(関連性、公開質問、期待される回答)を含む質
問に答え、レイアウト等について議論し、必要に応じて修正案を作成してもらう。
全ての言語版のPLがユーザーテストを受けるわけではなくreadabilityテストを実
施する言語は申請者が選択する。申請者が提案したPLテキストは、EMAのQRD
(Quality Review of the Documents)グループによって評価される。
•
•
EMA
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/procedure-review-information-medicinal- QRD(Quality Review of the Documents)
products-patients-consumers-organisations_en.pdf
ワーキンググループ
https://www.legislation.gov.uk/eudr/2004/27/pdfs/eudr_20040027_adopted_en.pdf
•
https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:02001L0083-20220101
https://www.ema.europa.eu/en/documents/presentation/presentation-what-package-leaflet-how-review-it-claireespinasse_en-0.pdf
https://health.ec.europa.eu/system/files/2016-11/2009_01_12_readability_guideline_final_en_0.pdf
https://www.ema.europa.eu/en/documents/presentation/presentation-how-patients-are-involved-reviewdocuments_en.pdf
https://learning.eupati.eu/mod/book/view.php?chapterid=773&id=859
•
(文書の品質レビューに関する作業部会)
製品情報の言語的明確性、一貫性、正確性
の確保
翻訳に使用されている用語と原文との整合
性を検証する
医薬品に関する欧州連合(EU)の規則を遵
守し、実務経験を考慮した科学委員会の意
見書及び製品情報のテンプレートの見直し
と更新
製品情報及び表示に関する法律及びガイド
ラインの実施に関する共通理解の構築に貢
献する
31