よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
C
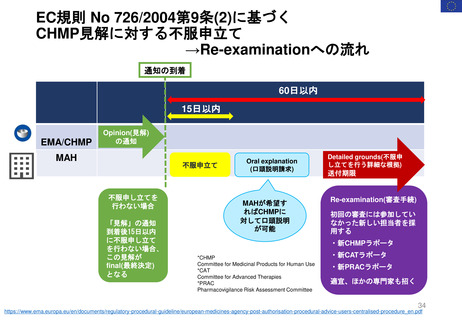
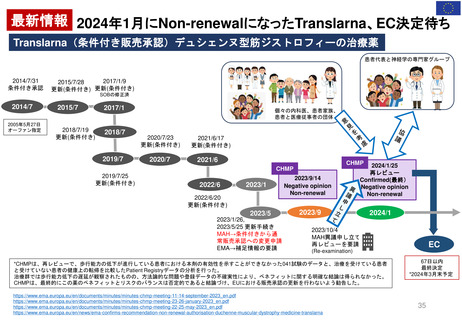
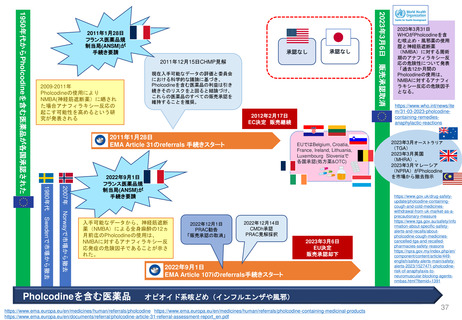
EMA/174255/2010 Rev. 2 に基づく
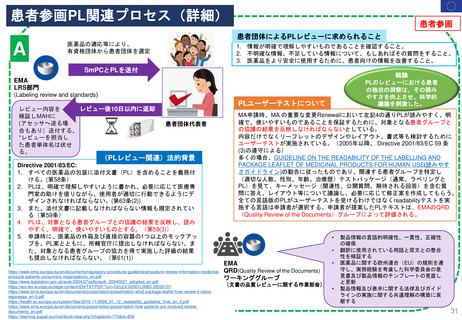
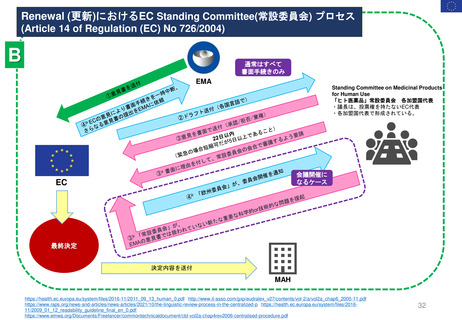
Renewal(更新)における患者参画
患者参画
Pre-Opinion linguistic review (文書レビュー)に専門家として参画する
Pre-opinion文書レビュー (linguistic review)担当
Quality Review of
Documents Working
Group (QRD)
文書品質レビュー
ワーキンググループ
EMA
Patients’ and
Consumers’
Organizations (PCO)
患者、消費者組織
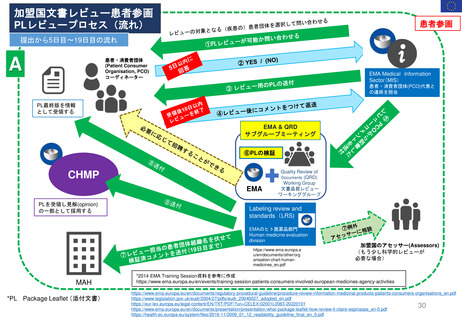
-CHMPが主体で行う Scientific assessment(科学的審査)に並行してlinguistic review(文
書レビュー)をEMAとQRD(文書品質レビューワーキンググループ)、PCO(患者・消
費者組織)の代表が実施する。レビューの対象はMAHによる提出書類のうち英語版の
PLであり、手続き開始から75日目までにコメントを作成しMAHに返送する。
-EMAとPCOとの協議・交流の目的は、文書を書き換えることではなく、情報が明確で
対象者に理解しやすく、情報の内容が公衆のニーズを満たしていることを確認すること
である。すべての医薬品のPLは、評価手続きの中で、対象となる患者グループに読み
やすさ、使いやすさについて相談した結果を反映することとなっている。
Directive 2004/27/ECで改正されたDirective 2001/83/ECの59条(3)及び61条(1)
関連法規
Directive 2001/83/EC, 59(3) (2022)
パッケージリーフレットは、対象患者グループとの協議の結果を反映し、読みやすく、明瞭で、使いやすいものとする。
The package leaflet shall reflect the results of consultations with target patient groups to ensure that it is legible, clear and easy to use.
Directive 2001/83/EC, 61(1) (2022)
医薬品の外箱及び直接の容器の1つ以上のモックアップを、添付文書案とともに、販売承認申請時に、販売承認を所管する当局に提出しなければな
らない。また、対象となる患者グループの協力を得て実施した評価の結果も、所轄官庁に提出しなければならない。
One or more mock-ups of the outer packaging and the immediate packaging of a medicinal product, together with the draft package leaflet, shall be
submitted to the authorities competent for authorising marketing when the marketing authorisation is requested. The results of assessments carried
out in cooperation with target patient groups shall also be provided to the competent authority.
用語参考:https://www.pmda.go.jp/files/000204693.pdf
PCO代表は、QRDメンバーと並行してレビューを行い、その後、コメントは両グループ(QRDメンバー及びPCO)同時にまとめられ、MAHに送
付される。EMAの要請により、受領したコメントや議論すべき事項によっては、PCOをEMA QRDサブグループ会議に参加させることができる。
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/procedure-review-information-medicinal-products-patients-consumers-organisations_en.pdf
https://www.legislation.gov.uk/eudr/2004/27/pdfs/eudr_20040027_adopted_en.pdf https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:02001L0083-20220101
https://www.ema.europa.eu/en/documents/presentation/presentation-what-package-leaflet-how-review-it-claire-espinasse_en-0.pdf
https://health.ec.europa.eu/system/files/2016-11/2009_01_12_readability_guideline_final_en_0.pdf
https://www.ema.europa.eu/en/documents/presentation/presentation-how-patients-are-involved-review-documents_en.pdf https://learning.eupati.eu/mod/book/view.php?chapterid=773&id=859
33
EMA/174255/2010 Rev. 2 に基づく
Renewal(更新)における患者参画
患者参画
Pre-Opinion linguistic review (文書レビュー)に専門家として参画する
Pre-opinion文書レビュー (linguistic review)担当
Quality Review of
Documents Working
Group (QRD)
文書品質レビュー
ワーキンググループ
EMA
Patients’ and
Consumers’
Organizations (PCO)
患者、消費者組織
-CHMPが主体で行う Scientific assessment(科学的審査)に並行してlinguistic review(文
書レビュー)をEMAとQRD(文書品質レビューワーキンググループ)、PCO(患者・消
費者組織)の代表が実施する。レビューの対象はMAHによる提出書類のうち英語版の
PLであり、手続き開始から75日目までにコメントを作成しMAHに返送する。
-EMAとPCOとの協議・交流の目的は、文書を書き換えることではなく、情報が明確で
対象者に理解しやすく、情報の内容が公衆のニーズを満たしていることを確認すること
である。すべての医薬品のPLは、評価手続きの中で、対象となる患者グループに読み
やすさ、使いやすさについて相談した結果を反映することとなっている。
Directive 2004/27/ECで改正されたDirective 2001/83/ECの59条(3)及び61条(1)
関連法規
Directive 2001/83/EC, 59(3) (2022)
パッケージリーフレットは、対象患者グループとの協議の結果を反映し、読みやすく、明瞭で、使いやすいものとする。
The package leaflet shall reflect the results of consultations with target patient groups to ensure that it is legible, clear and easy to use.
Directive 2001/83/EC, 61(1) (2022)
医薬品の外箱及び直接の容器の1つ以上のモックアップを、添付文書案とともに、販売承認申請時に、販売承認を所管する当局に提出しなければな
らない。また、対象となる患者グループの協力を得て実施した評価の結果も、所轄官庁に提出しなければならない。
One or more mock-ups of the outer packaging and the immediate packaging of a medicinal product, together with the draft package leaflet, shall be
submitted to the authorities competent for authorising marketing when the marketing authorisation is requested. The results of assessments carried
out in cooperation with target patient groups shall also be provided to the competent authority.
用語参考:https://www.pmda.go.jp/files/000204693.pdf
PCO代表は、QRDメンバーと並行してレビューを行い、その後、コメントは両グループ(QRDメンバー及びPCO)同時にまとめられ、MAHに送
付される。EMAの要請により、受領したコメントや議論すべき事項によっては、PCOをEMA QRDサブグループ会議に参加させることができる。
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/procedure-review-information-medicinal-products-patients-consumers-organisations_en.pdf
https://www.legislation.gov.uk/eudr/2004/27/pdfs/eudr_20040027_adopted_en.pdf https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:02001L0083-20220101
https://www.ema.europa.eu/en/documents/presentation/presentation-what-package-leaflet-how-review-it-claire-espinasse_en-0.pdf
https://health.ec.europa.eu/system/files/2016-11/2009_01_12_readability_guideline_final_en_0.pdf
https://www.ema.europa.eu/en/documents/presentation/presentation-how-patients-are-involved-review-documents_en.pdf https://learning.eupati.eu/mod/book/view.php?chapterid=773&id=859
33