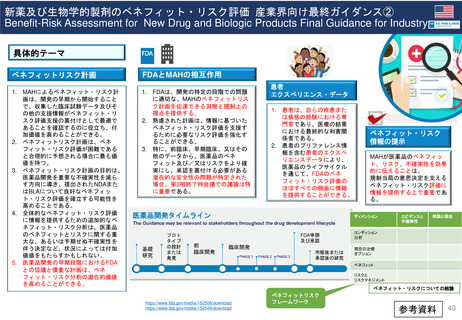
よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
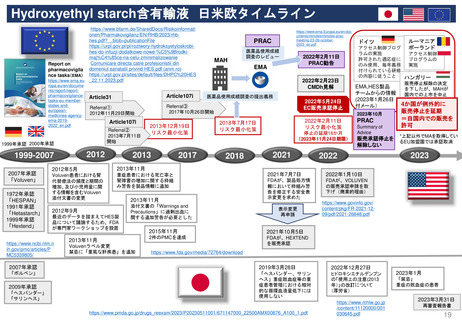
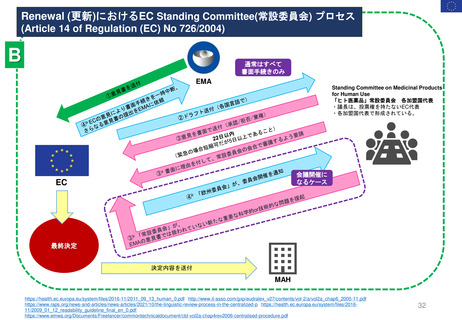
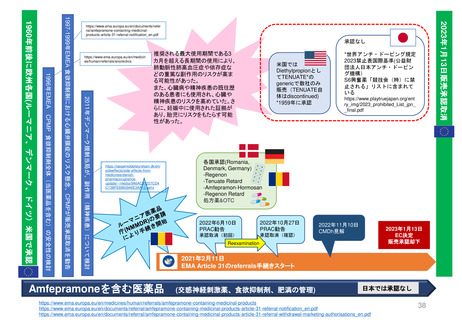
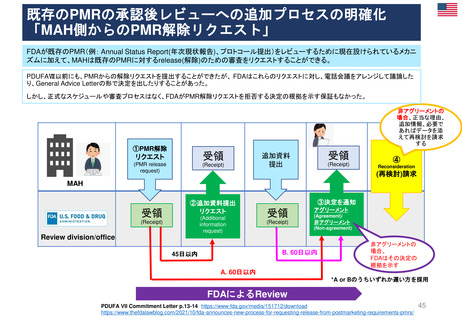
2013年3月25日
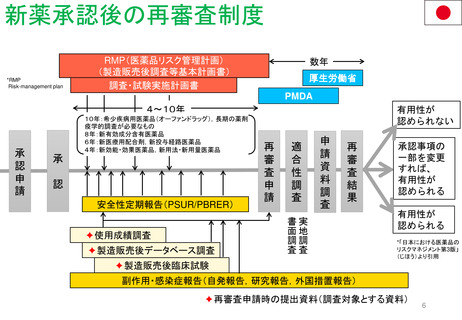
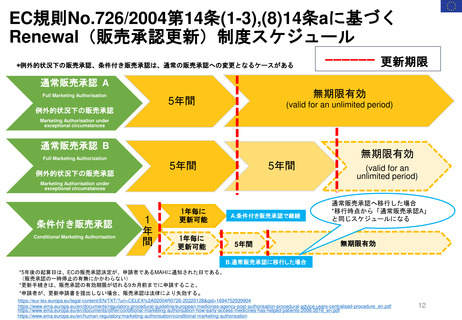
販売承認
「ボルベン」
2013年6月13日
PRAC勧告
全ての患者集団に対して
EU内での使用を一時中止
2013年6月27日
英国使用一時停止
「敗血症(血液中の細菌感染)、熱傷、
重症患者の治療には、腎障害と死亡の
リスクが高まるため、HES輸液を使用
してはならない」と結論づけた。
CMDh見解→EC最終決定
①
2013年10月10日
PRAC勧告
2013年10月23日
CMDh見解
限定された患者
集団での使用を
可能とする
2013年7月11日
Article 107i 手続きスタート
http://www.nihs.go.jp/dig/sireport/weekly11/181308
29.pdf
https://www.ema.europa.eu/en/news/pracrecommends-suspending-marketingauthorisations-infusion-solutions-containinghydroxyethyl-starch
2018年
1月12日
PRAC
勧告
https://www.info.pmda.go.jp/kaiteip/2
0130917A001/05.pdf
②
2018年
6月27日
CMDh見解
販売継続
2018年7月17日
EC決定
Risk minimisation
measures
リスク最小化策
2017年10月26日
③
Article 107i 手続きスタート
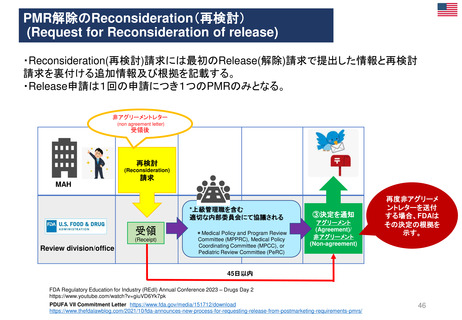
①使用を認定病院に制限する
②処方者は適切な使用に関する
研修を受講する
③製品情報に敗血症、腎臓障害
のある患者、重症患者などに使
用不可と警告した
④医療従事者に、使用条件やリ
スクのため投与してはならない
患者群につき書面の送付
⑤MAHは、制限事項遵守
確認のため薬剤使用成績
調査(drug utilization
study)を実施しその結果
をEMAに提出することが
求められた。
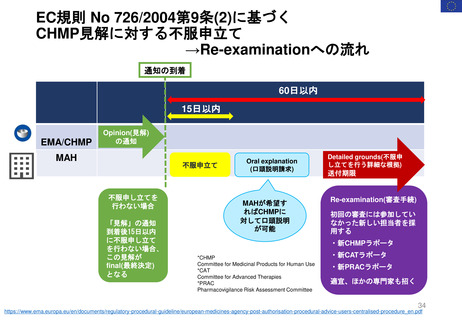
2022年2月11日
PRAC勧告
2023年3月31日
再審査報告書
「本剤については、医薬品リスク
管理計画は策定されていない」
https://www.pmda.go.jp/drugs_reexam/
2023/P20230511001/671147000_2250
0AMX00876_A100_1.pdf
2023年11月21日
ドイツBfArM
販売承認停止解除
要件を満たした
許可された適応症に
のみ使用され、毎年
義務付けられている
研修の内容に従い 2023年11月24日
ドイツBfArM
使用すること。
https://www.bfarm.de/Sh販売承認一時停止
aredDocs/Risikoinformatを命じない
ionen/Pharmakovigilanz/https://www.bfarm.de
EN/RHB/2023/rhb/SharedDocs/Risikoin
hes.html?nn=968840 formationen/Pharmak
ovigilanz/EN/RV_ST
P/g-l/hesneu2017.html
EC決定
2022年2月23日
CMDh見解
が多数決で採択される
2021年7月7日
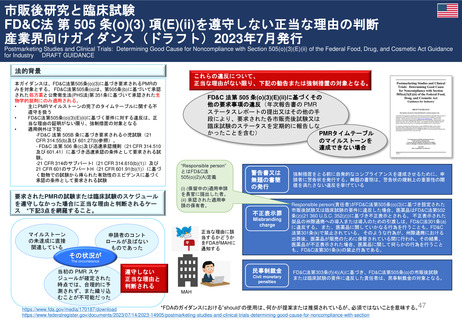
FDAは、ヒドロキシエチルスターチ製品の処方情報において、
死亡率、腎臓障害、過剰出血のリスクについて警告するために
枠囲み警告(Boxed Warning)を修正する安全表示変更を求め
ている。 また「効能・効果」、「禁忌」、「警告・注意」、
「副作用」の各項目についても関連する変更を要求している
https://www.freseniuskabi.com/jp/documents/HES含有
製剤適正使用のお願い_20230112
掲載.pdf
2023年10月23-26日
PRAC
公衆衛生上の理由で必要
な場合、個々のEU加盟国
は、合意されたリスク最
小化策に従って、18ヶ月
を超えない範囲で販売承
認停止を延期し、HES輸
液を市場に維持すること
ができる。
Summary of Advice
現在MAを取得してい
る4つの加盟国(ドイツ、
ハンガリー、ポーランド、
ルーマニアにおいて
HESの販売承認停止
を解除しない。
18か月の期限到来
本調査の結果を検討、HES輸液が製
品情報に含まれる推奨事項以外でも使
用されていることが判明した。PRAC
は、2018年に導入されたさらなる制
限は、医薬品が安全に使用されること
を十分に保証しておらず、特定の患者
集団が以前として深刻なリスクに晒さ
れている。
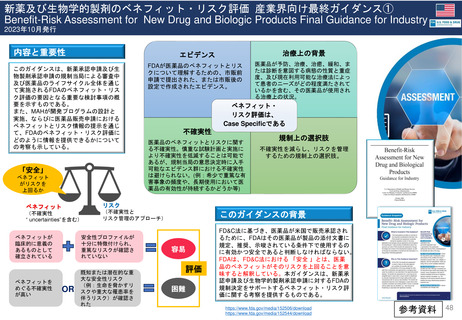
2019年3月28日
「ヘスパンダー、サリンヘス」
「重症敗血症等の重症患者管理
における相対的な循環血液量低
下には使用しないこと。」
2023年1月
HES製剤の適正使用について
[禁忌]重症の敗血症の患者
2023年11月24日
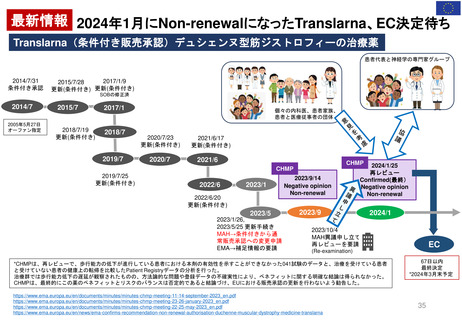
2007年12月27日米国承認
2000年7月25日英国承認
1999年6月22日ドイツ承認
販売承認
一時停止
2013年12月19日
EC決定
Risk minimisation
measures
リスク最小化策
2022年5月24日 販売承認停止(Suspension)
2012年11月29日
Article 31 手続きスタート
Hydroxyethyl starch ヒドロキシエチルデンプン含有輸液 人工膠質液「HES含有輸液」
https://www.ema.europa.eu/en/news/hydroxyethyl-starch-solutions-infusion-recommended-suspension-market
https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/labeling-changes-mortality-kidney-injury-and-excess-bleeding-hydroxyethyl-starch-products
https://www.ema.europa.eu/en/medicines/human/referrals/hydroxyethyl-starch-solutions-infusion
https://www.ema.europa.eu/en/documents/referral/prac-confirms-hydroxyethyl-starch-solutions-hes-should-no-longer-be-used-patients-sepsis-burn_en-0.pdf
https://ec.europa.eu/health/documents/community-register/2022/20220524155341/dec_155341_en.pdf
*2023年11月24日以降の詳細に
ついてはスライド19を
ご参照ください
39
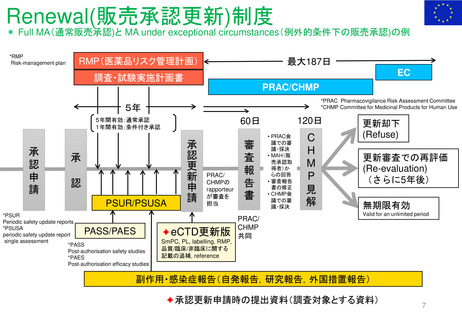
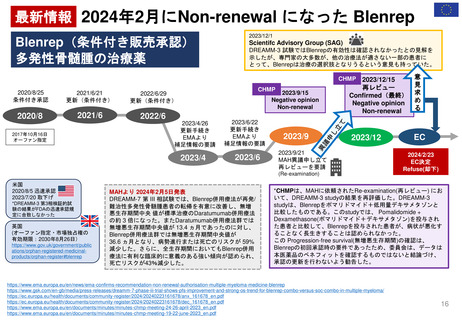
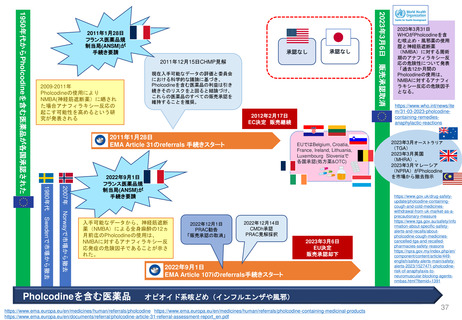
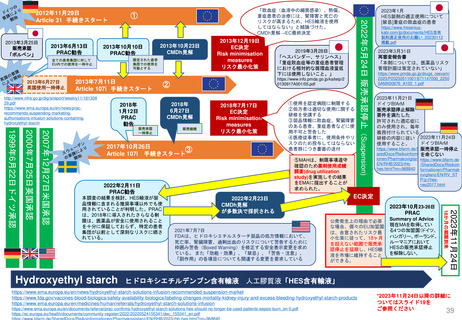
販売承認
「ボルベン」
2013年6月13日
PRAC勧告
全ての患者集団に対して
EU内での使用を一時中止
2013年6月27日
英国使用一時停止
「敗血症(血液中の細菌感染)、熱傷、
重症患者の治療には、腎障害と死亡の
リスクが高まるため、HES輸液を使用
してはならない」と結論づけた。
CMDh見解→EC最終決定
①
2013年10月10日
PRAC勧告
2013年10月23日
CMDh見解
限定された患者
集団での使用を
可能とする
2013年7月11日
Article 107i 手続きスタート
http://www.nihs.go.jp/dig/sireport/weekly11/181308
29.pdf
https://www.ema.europa.eu/en/news/pracrecommends-suspending-marketingauthorisations-infusion-solutions-containinghydroxyethyl-starch
2018年
1月12日
PRAC
勧告
https://www.info.pmda.go.jp/kaiteip/2
0130917A001/05.pdf
②
2018年
6月27日
CMDh見解
販売継続
2018年7月17日
EC決定
Risk minimisation
measures
リスク最小化策
2017年10月26日
③
Article 107i 手続きスタート
①使用を認定病院に制限する
②処方者は適切な使用に関する
研修を受講する
③製品情報に敗血症、腎臓障害
のある患者、重症患者などに使
用不可と警告した
④医療従事者に、使用条件やリ
スクのため投与してはならない
患者群につき書面の送付
⑤MAHは、制限事項遵守
確認のため薬剤使用成績
調査(drug utilization
study)を実施しその結果
をEMAに提出することが
求められた。
2022年2月11日
PRAC勧告
2023年3月31日
再審査報告書
「本剤については、医薬品リスク
管理計画は策定されていない」
https://www.pmda.go.jp/drugs_reexam/
2023/P20230511001/671147000_2250
0AMX00876_A100_1.pdf
2023年11月21日
ドイツBfArM
販売承認停止解除
要件を満たした
許可された適応症に
のみ使用され、毎年
義務付けられている
研修の内容に従い 2023年11月24日
ドイツBfArM
使用すること。
https://www.bfarm.de/Sh販売承認一時停止
aredDocs/Risikoinformatを命じない
ionen/Pharmakovigilanz/https://www.bfarm.de
EN/RHB/2023/rhb/SharedDocs/Risikoin
hes.html?nn=968840 formationen/Pharmak
ovigilanz/EN/RV_ST
P/g-l/hesneu2017.html
EC決定
2022年2月23日
CMDh見解
が多数決で採択される
2021年7月7日
FDAは、ヒドロキシエチルスターチ製品の処方情報において、
死亡率、腎臓障害、過剰出血のリスクについて警告するために
枠囲み警告(Boxed Warning)を修正する安全表示変更を求め
ている。 また「効能・効果」、「禁忌」、「警告・注意」、
「副作用」の各項目についても関連する変更を要求している
https://www.freseniuskabi.com/jp/documents/HES含有
製剤適正使用のお願い_20230112
掲載.pdf
2023年10月23-26日
PRAC
公衆衛生上の理由で必要
な場合、個々のEU加盟国
は、合意されたリスク最
小化策に従って、18ヶ月
を超えない範囲で販売承
認停止を延期し、HES輸
液を市場に維持すること
ができる。
Summary of Advice
現在MAを取得してい
る4つの加盟国(ドイツ、
ハンガリー、ポーランド、
ルーマニアにおいて
HESの販売承認停止
を解除しない。
18か月の期限到来
本調査の結果を検討、HES輸液が製
品情報に含まれる推奨事項以外でも使
用されていることが判明した。PRAC
は、2018年に導入されたさらなる制
限は、医薬品が安全に使用されること
を十分に保証しておらず、特定の患者
集団が以前として深刻なリスクに晒さ
れている。
2019年3月28日
「ヘスパンダー、サリンヘス」
「重症敗血症等の重症患者管理
における相対的な循環血液量低
下には使用しないこと。」
2023年1月
HES製剤の適正使用について
[禁忌]重症の敗血症の患者
2023年11月24日
2007年12月27日米国承認
2000年7月25日英国承認
1999年6月22日ドイツ承認
販売承認
一時停止
2013年12月19日
EC決定
Risk minimisation
measures
リスク最小化策
2022年5月24日 販売承認停止(Suspension)
2012年11月29日
Article 31 手続きスタート
Hydroxyethyl starch ヒドロキシエチルデンプン含有輸液 人工膠質液「HES含有輸液」
https://www.ema.europa.eu/en/news/hydroxyethyl-starch-solutions-infusion-recommended-suspension-market
https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/labeling-changes-mortality-kidney-injury-and-excess-bleeding-hydroxyethyl-starch-products
https://www.ema.europa.eu/en/medicines/human/referrals/hydroxyethyl-starch-solutions-infusion
https://www.ema.europa.eu/en/documents/referral/prac-confirms-hydroxyethyl-starch-solutions-hes-should-no-longer-be-used-patients-sepsis-burn_en-0.pdf
https://ec.europa.eu/health/documents/community-register/2022/20220524155341/dec_155341_en.pdf
*2023年11月24日以降の詳細に
ついてはスライド19を
ご参照ください
39