よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
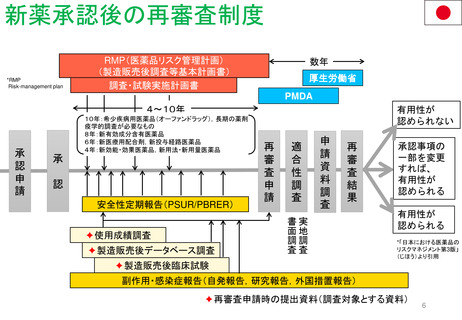
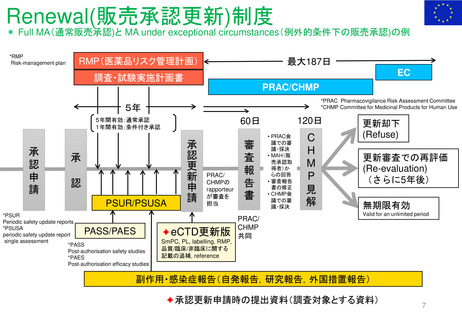
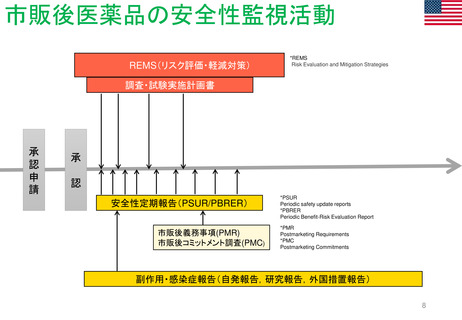
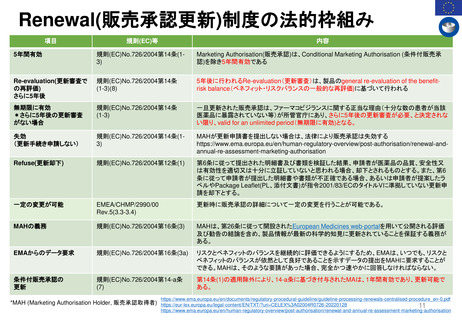
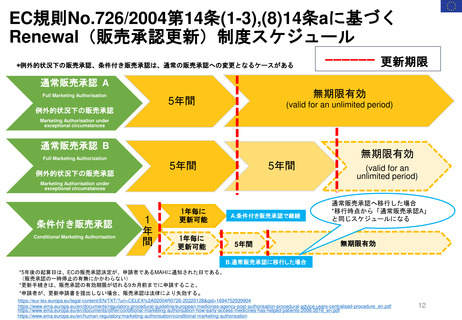
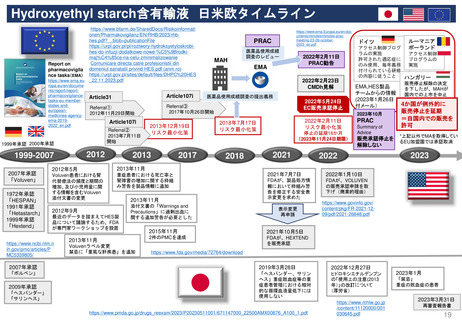
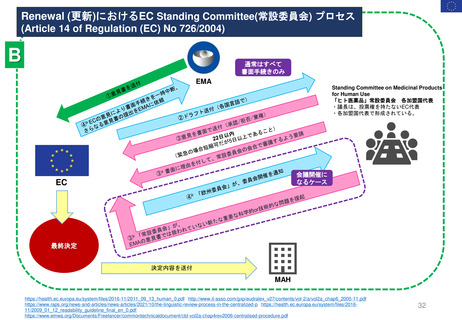
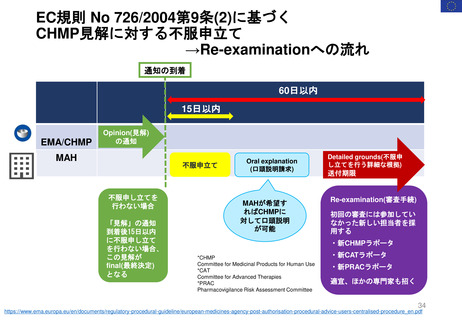
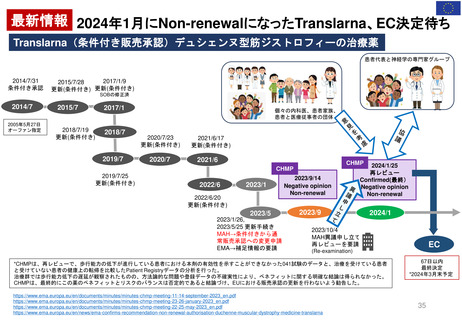
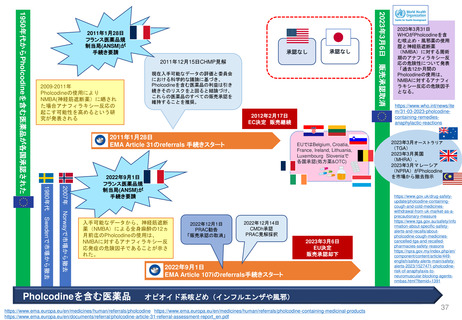
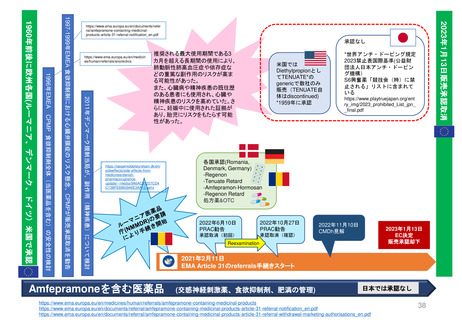
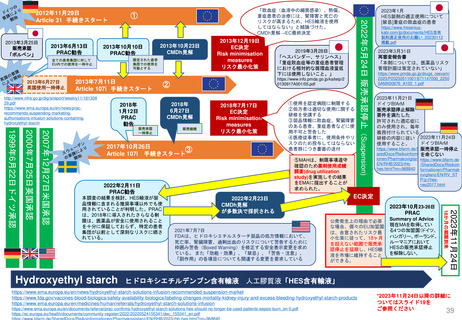
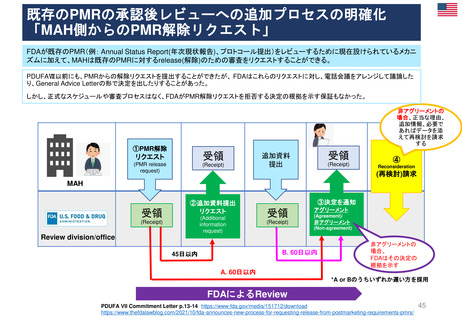
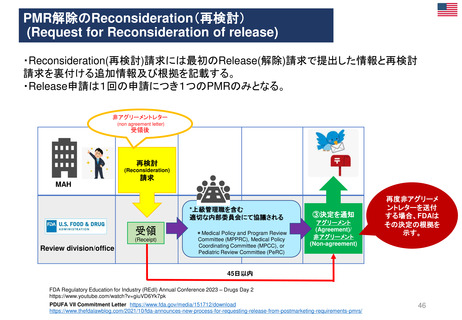
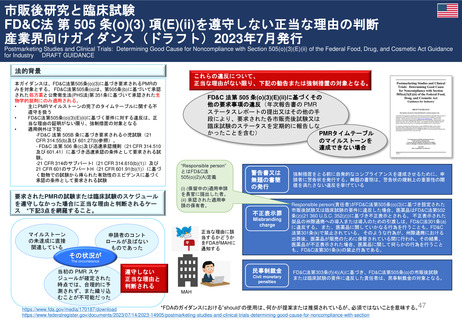
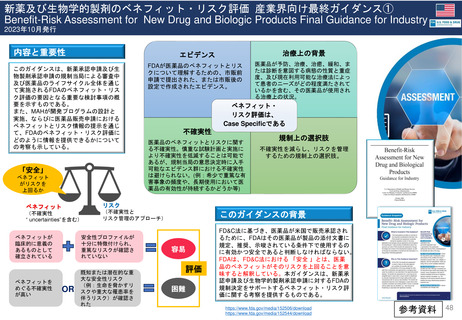
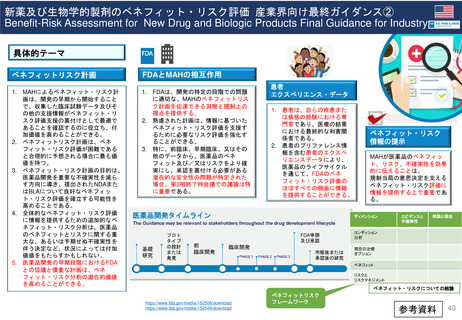
Hydroxyethyl starch含有輸液 日米欧タイムライン
Report on
pharmacovigila
nce tasks(EMA)
https://www.ema.eu
ropa.eu/en/docume
nts/report/reportpharmacovigilancetasks-eu-memberstates-andeuropeanmedicines-agencyema-20192022_en.pdf
https://www.bfarm.de/SharedDocs/Risikoinformati
onen/Pharmakovigilanz/EN/RHB/2023/rhbhes.pdf?__blob=publicationFile
https://urpl.gov.pl/pl/roztwory-hydroksyetyloskrobihes-do-infuzji-dodatkowe-nowe-%C5%9Brodkimaj%C4%85ce-na-celu-zminimalizowanie
Comunicare directa catre profesionistii din
domeniul sanatatii privind HES.pdf (anm.ro)
https://urpl.gov.pl/sites/default/files/DHPC%20HES
_22.11.2023.pdf
2012
1972年承認
「HESPAN」
1991年承認
「Hetastarch」
1999年承認
「Hextend」
2013
2012年5月
2013年11月
Voluven患者における腎
代替療法の頻度と期間の
増加、及び小児用量に関
する情報を含むVoluven
添付文書の変更
重症患者における死亡率と
腎障害の増加に関する枠組
み警告を製品情報に追加
2012年9月
最近のデータを踏まえてHES製
品について議論するため、FDA
が専門家ワークショップを設置
https://www.ncbi.nlm.n
ih.gov/pmc/articles/P
MC5359805/
2017
2022年2月11日
PRAC勧告
2022年2月23日
CMDh見解
Referral①
2012年11月29日開始
2013年12月19日
リスク最小化策
医薬品使用成績
調査のレビュー
EMA
Referral③
2017年10月26日開始
1999年承認 2000年承認
2007年承認
「Voluven」
MAH
Article107i
Referral②
2013年7月11日
開始
1999-2007
PRAC
Article31
Article107i
https://www.ema.Europa.eu/en/doc
uments/minutes/minutes-pracmeeting-23-26-october2023_en.pdf
医薬品使用成績調査の提出義務
2022年5月24日
EC販売承認停止
2022年2月11日
リスク最小化策
2018年7月17日
リスク最小化策
2018
停止の延期18か月
(2023年11月24日期限)
2021
PRAC
Summary of
Advice
販売承認停止を
解除しない
2022
2022年1月10日
FDAが、製品処方情
報において枠組み警
告を修正する安全表
示変更を求めた
FDAが、VOLUVEN
の販売承認申請を取
下げ(商業的理由)
表示変更
再申請
2015年11月
2021年10月5日
2件のPMCを達成
FDAが、HEXTEND
を販売承認
Voluvenラベル変更
禁忌に「重篤な肝疾患」を追加
(2023年1月26日
付メール)
2021年7月7日
添付文書の「Warnings and
Precautions」に過剰出血に
関する追加警告が必要とした
*上記以外でMAを取得してい
るEU加盟国では承認取消
2023
https://www.fda.gov/media/72764/download
2019年3月28日
2022年12月27日
「ボルベン」
「ヘスパンダー、サリン
ヘス」重症敗血症等の重
症患者管理における相対
的な循環血液量低下には
使用しない
ヒドロキシエチルデンプン
の「使用上の注意(2013
年)」の改訂について
(厚労省)
「ヘスパンダー」
「サリンヘス」
4か国が例外的に
販売停止を延期
=自国内での販売を
許可
https://www.govinfo.gov/
content/pkg/FR-2021-1209/pdf/2021-26648.pdf
2007年承認
2009年承認
ルーマニア
アクセス制御プログ
ポーランド
ラムの実施
アクセス制御
許可された適応症に
プログラムの
のみ使用、毎年義務
実施
付けられている研修
の内容に従うこと
ハンガリー
販売停止解除の決定
EMA,HES製品
を下したが、MAHが
チームからの情報
国内での上市を中止
2023年10月
2013年11月
2013年11月
ドイツ
https://www.pmda.go.jp/drugs_reexam/2023/P20230511001/671147000_22500AMX00876_A100_1.pdf
https://www.mhlw.go.jp
/content/11120000/001
030645.pdf
2023年1月
「禁忌」
重症の敗血症の患者
2023年3月31日
再審査報告書
19
Report on
pharmacovigila
nce tasks(EMA)
https://www.ema.eu
ropa.eu/en/docume
nts/report/reportpharmacovigilancetasks-eu-memberstates-andeuropeanmedicines-agencyema-20192022_en.pdf
https://www.bfarm.de/SharedDocs/Risikoinformati
onen/Pharmakovigilanz/EN/RHB/2023/rhbhes.pdf?__blob=publicationFile
https://urpl.gov.pl/pl/roztwory-hydroksyetyloskrobihes-do-infuzji-dodatkowe-nowe-%C5%9Brodkimaj%C4%85ce-na-celu-zminimalizowanie
Comunicare directa catre profesionistii din
domeniul sanatatii privind HES.pdf (anm.ro)
https://urpl.gov.pl/sites/default/files/DHPC%20HES
_22.11.2023.pdf
2012
1972年承認
「HESPAN」
1991年承認
「Hetastarch」
1999年承認
「Hextend」
2013
2012年5月
2013年11月
Voluven患者における腎
代替療法の頻度と期間の
増加、及び小児用量に関
する情報を含むVoluven
添付文書の変更
重症患者における死亡率と
腎障害の増加に関する枠組
み警告を製品情報に追加
2012年9月
最近のデータを踏まえてHES製
品について議論するため、FDA
が専門家ワークショップを設置
https://www.ncbi.nlm.n
ih.gov/pmc/articles/P
MC5359805/
2017
2022年2月11日
PRAC勧告
2022年2月23日
CMDh見解
Referral①
2012年11月29日開始
2013年12月19日
リスク最小化策
医薬品使用成績
調査のレビュー
EMA
Referral③
2017年10月26日開始
1999年承認 2000年承認
2007年承認
「Voluven」
MAH
Article107i
Referral②
2013年7月11日
開始
1999-2007
PRAC
Article31
Article107i
https://www.ema.Europa.eu/en/doc
uments/minutes/minutes-pracmeeting-23-26-october2023_en.pdf
医薬品使用成績調査の提出義務
2022年5月24日
EC販売承認停止
2022年2月11日
リスク最小化策
2018年7月17日
リスク最小化策
2018
停止の延期18か月
(2023年11月24日期限)
2021
PRAC
Summary of
Advice
販売承認停止を
解除しない
2022
2022年1月10日
FDAが、製品処方情
報において枠組み警
告を修正する安全表
示変更を求めた
FDAが、VOLUVEN
の販売承認申請を取
下げ(商業的理由)
表示変更
再申請
2015年11月
2021年10月5日
2件のPMCを達成
FDAが、HEXTEND
を販売承認
Voluvenラベル変更
禁忌に「重篤な肝疾患」を追加
(2023年1月26日
付メール)
2021年7月7日
添付文書の「Warnings and
Precautions」に過剰出血に
関する追加警告が必要とした
*上記以外でMAを取得してい
るEU加盟国では承認取消
2023
https://www.fda.gov/media/72764/download
2019年3月28日
2022年12月27日
「ボルベン」
「ヘスパンダー、サリン
ヘス」重症敗血症等の重
症患者管理における相対
的な循環血液量低下には
使用しない
ヒドロキシエチルデンプン
の「使用上の注意(2013
年)」の改訂について
(厚労省)
「ヘスパンダー」
「サリンヘス」
4か国が例外的に
販売停止を延期
=自国内での販売を
許可
https://www.govinfo.gov/
content/pkg/FR-2021-1209/pdf/2021-26648.pdf
2007年承認
2009年承認
ルーマニア
アクセス制御プログ
ポーランド
ラムの実施
アクセス制御
許可された適応症に
プログラムの
のみ使用、毎年義務
実施
付けられている研修
の内容に従うこと
ハンガリー
販売停止解除の決定
EMA,HES製品
を下したが、MAHが
チームからの情報
国内での上市を中止
2023年10月
2013年11月
2013年11月
ドイツ
https://www.pmda.go.jp/drugs_reexam/2023/P20230511001/671147000_22500AMX00876_A100_1.pdf
https://www.mhlw.go.jp
/content/11120000/001
030645.pdf
2023年1月
「禁忌」
重症の敗血症の患者
2023年3月31日
再審査報告書
19