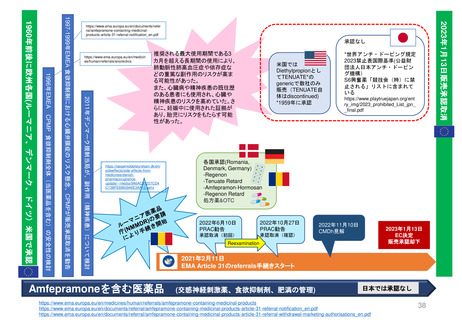
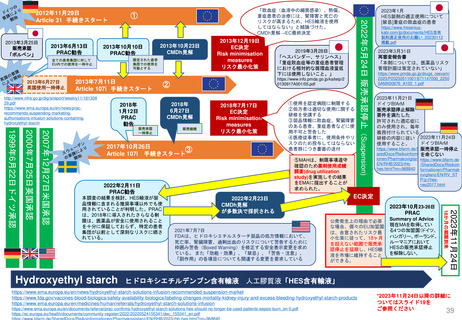
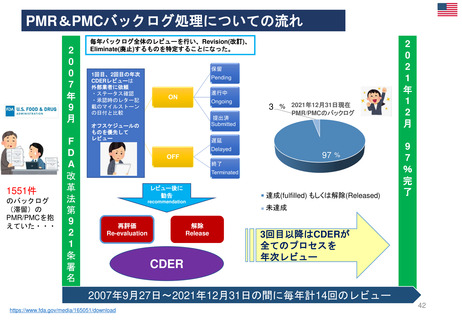
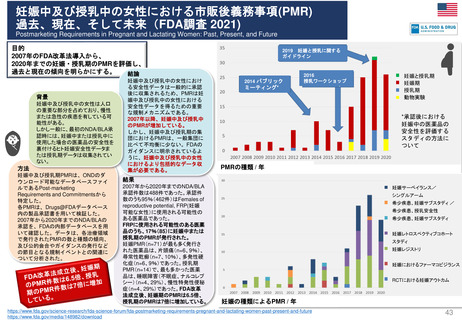
よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (29 ページ)
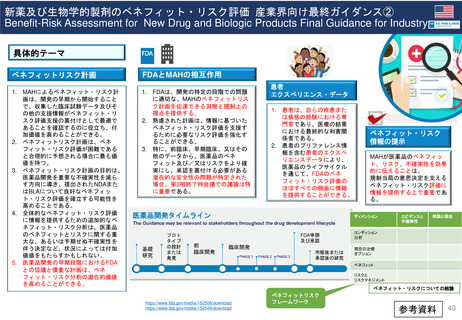
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
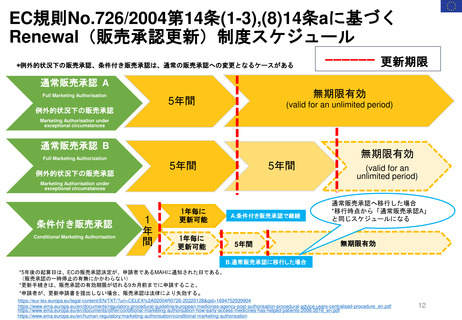
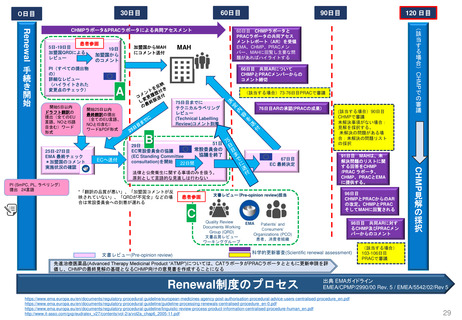
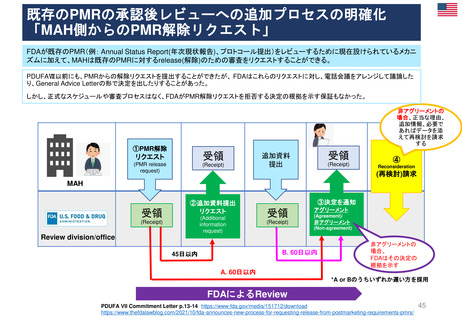
30日目
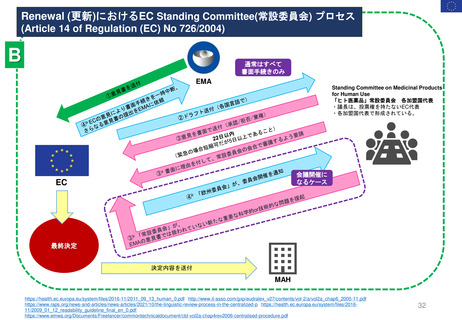
Renewal
60日目
0日目
CHMPラポータ&PRACラポータによる共同アセスメント
19日
加盟国から
のコメント
PI(すべての提出物
の)
詳細なレビュー
(ハイライトされた
変更点のチェック)
開始5日以内
ドラフト翻訳の
提出(全てのEU
言語、NOとIS語
目含む)ワード
形式
加盟国からMAH
にコメント送付
(
該
当
す
る
場
合
)
60日目 CHMPラポータと
PRACラポータの共同アセス
メントレポート(AR)を受領
EMA、CHMP、PRACメン
バー、MAHに回覧し主要な問
題があればハイライトする
MAH
66日目 共同ARについて
CHMPとPRACメンバーからの
コメント締切
A
CHMP
手
続
き
開
始
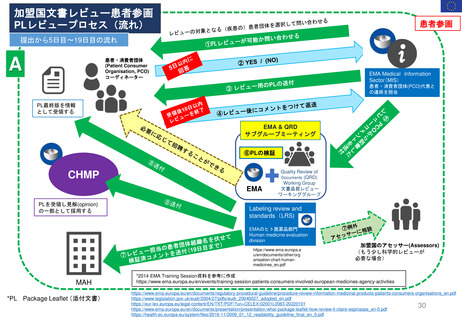
患者参画
5日-19日目
加盟国QRDによる
レビュー
(該当する場合)73-76日目PRACで審議
75日目までに
テクニカルラベリング
レビュー
(Technical Labelling
Review)コメント到着
開始25日以内
最終翻訳の提出
(全てのEU言語、
NOとIS含む)
ワード&PDF形式
76日目ARの承認(PRACの成果)
B
ECへ送付
51日
29日
常設委員会の
EC常設委員会の協議
協議を終了
(EC Standing Committee
consultation)を開始
22日間
91日目 MAHは、未
解決問題のリストに関
する回答をCHMP
/PRAC ラポータ、
CHMP、PRACとEMA
に提供する。
67日目
EC 最終決定
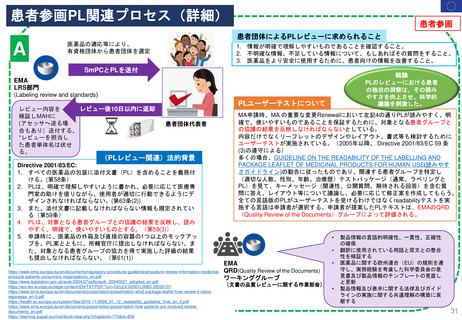
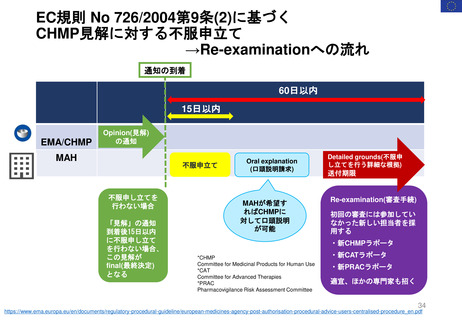
法律と公衆衛生に関する事項のみを扱う。
原則として言語的な見直しは行わない
PI (SmPC, PL, ラベリング)
提出 24言語
*「翻訳の品質が悪い」、「加盟国コメントが反
映されていない」、「QRDが不完全」などの場
合は常設委員会への到着が遅れる
患者参画
96日目
CHMPとPRACからのAR
の改定。CHMPとPRAC
そしてMAHに回覧される
文書レビュー(Pre-opinion review)担当
C
Quality Review of
Documents Working
Group (QRD)
文書品質レビュー
ワーキンググループ
文書レビュー(Pre-opinion review)
(該当する場合)90日目
CHMPで審議
未解決事項がない場合:
見解を採択する。
未解決の問題がある場
合:未解決の問題リスト
の採択
98日目 共同ARに対す
るCHMP及びPRACメン
バーからのコメント
EMA
Patients’ and
Consumers’
Organizations (PCO)
患者、消費者組織
科学的更新審査(Scientific renewal assessment)
先進治療医薬品(Advanced Therapy Medicinal Product “ATMP”)については、CATラポータがPRACラポータとともに更新申請を評
価し、CHMPの最終見解の基礎となるCHMP向けの意見書を作成することになる
Renewal制度のプロセス
で
の
審
議
CHMP
25日-27日目
EMA 最終チェック
*加盟国のコメント
実施状況の確認
120 日目
90日目
見
解
の
採
択
(該当する場合)
103-106日目
PRACで審議
出典 EMAガイドライン
EMEA/CPMP/2990/00 Rev. 5 / EMEA/5542/02/Rev 5
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/european-medicines-agency-post-authorisation-procedural-advice-users-centralised-procedure_en.pdf
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/guideline-processing-renewals-centralised-procedure_en-0.pdf
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/linguistic-review-process-product-information-centralised-procedure-human_en.pdf
http://www.it-asso.com/gxp/eudralex_v27/contents/vol-2/a/vol2a_chap6_2005-11.pdf
29
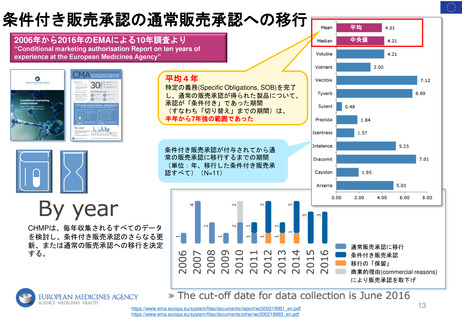
Renewal
60日目
0日目
CHMPラポータ&PRACラポータによる共同アセスメント
19日
加盟国から
のコメント
PI(すべての提出物
の)
詳細なレビュー
(ハイライトされた
変更点のチェック)
開始5日以内
ドラフト翻訳の
提出(全てのEU
言語、NOとIS語
目含む)ワード
形式
加盟国からMAH
にコメント送付
(
該
当
す
る
場
合
)
60日目 CHMPラポータと
PRACラポータの共同アセス
メントレポート(AR)を受領
EMA、CHMP、PRACメン
バー、MAHに回覧し主要な問
題があればハイライトする
MAH
66日目 共同ARについて
CHMPとPRACメンバーからの
コメント締切
A
CHMP
手
続
き
開
始
患者参画
5日-19日目
加盟国QRDによる
レビュー
(該当する場合)73-76日目PRACで審議
75日目までに
テクニカルラベリング
レビュー
(Technical Labelling
Review)コメント到着
開始25日以内
最終翻訳の提出
(全てのEU言語、
NOとIS含む)
ワード&PDF形式
76日目ARの承認(PRACの成果)
B
ECへ送付
51日
29日
常設委員会の
EC常設委員会の協議
協議を終了
(EC Standing Committee
consultation)を開始
22日間
91日目 MAHは、未
解決問題のリストに関
する回答をCHMP
/PRAC ラポータ、
CHMP、PRACとEMA
に提供する。
67日目
EC 最終決定
法律と公衆衛生に関する事項のみを扱う。
原則として言語的な見直しは行わない
PI (SmPC, PL, ラベリング)
提出 24言語
*「翻訳の品質が悪い」、「加盟国コメントが反
映されていない」、「QRDが不完全」などの場
合は常設委員会への到着が遅れる
患者参画
96日目
CHMPとPRACからのAR
の改定。CHMPとPRAC
そしてMAHに回覧される
文書レビュー(Pre-opinion review)担当
C
Quality Review of
Documents Working
Group (QRD)
文書品質レビュー
ワーキンググループ
文書レビュー(Pre-opinion review)
(該当する場合)90日目
CHMPで審議
未解決事項がない場合:
見解を採択する。
未解決の問題がある場
合:未解決の問題リスト
の採択
98日目 共同ARに対す
るCHMP及びPRACメン
バーからのコメント
EMA
Patients’ and
Consumers’
Organizations (PCO)
患者、消費者組織
科学的更新審査(Scientific renewal assessment)
先進治療医薬品(Advanced Therapy Medicinal Product “ATMP”)については、CATラポータがPRACラポータとともに更新申請を評
価し、CHMPの最終見解の基礎となるCHMP向けの意見書を作成することになる
Renewal制度のプロセス
で
の
審
議
CHMP
25日-27日目
EMA 最終チェック
*加盟国のコメント
実施状況の確認
120 日目
90日目
見
解
の
採
択
(該当する場合)
103-106日目
PRACで審議
出典 EMAガイドライン
EMEA/CPMP/2990/00 Rev. 5 / EMEA/5542/02/Rev 5
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/european-medicines-agency-post-authorisation-procedural-advice-users-centralised-procedure_en.pdf
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/guideline-processing-renewals-centralised-procedure_en-0.pdf
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/linguistic-review-process-product-information-centralised-procedure-human_en.pdf
http://www.it-asso.com/gxp/eudralex_v27/contents/vol-2/a/vol2a_chap6_2005-11.pdf
29