よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
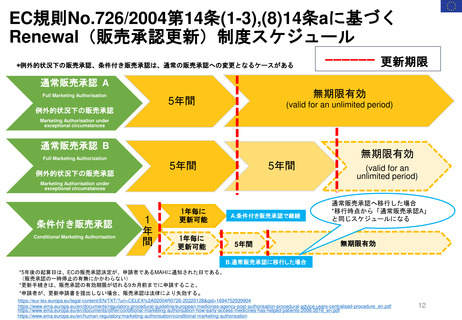
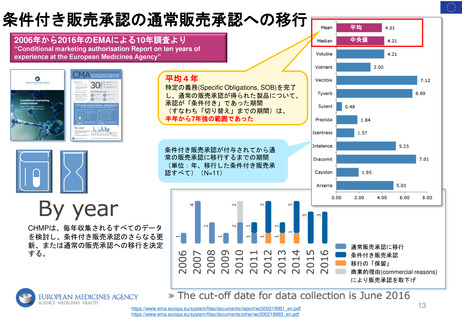
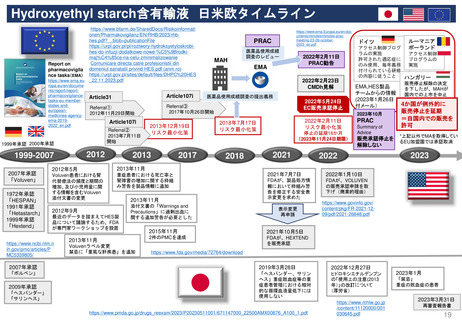
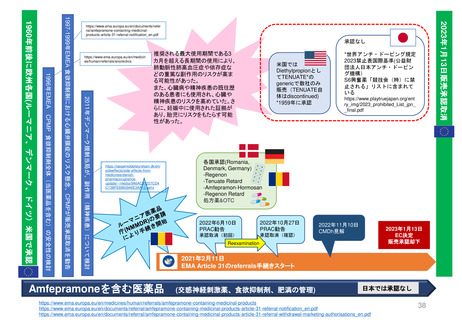
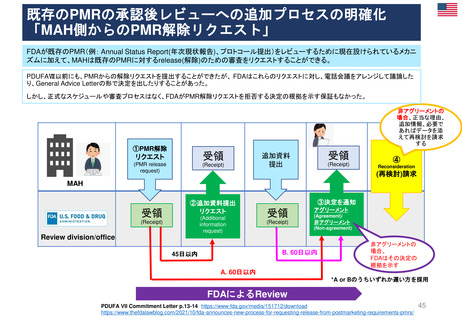
条件付き販売承認の通常販売承認への移行
2006年から2016年のEMAによる10年調査より
平均
中央値
“Conditional marketing authorisation Report on ten years of
experience at the European Medicines Agency”
平均4年
特定の義務(Specific Obligations, SOB)を完了
し、通常の販売承認が得られた製品について、
承認が「条件付き」であった期間
(すなわち「切り替え」までの期間)は、
半年から7年強の範囲であった
条件付き販売承認が付与されてから通
常の販売承認に移行するまでの期間
(単位:年、移行した条件付き販売承
認すべて)(N=11)
CHMPは、毎年収集されるすべてのデータ
を検討し、条件付き販売承認のさらなる更
新、または通常の販売承認への移行を決定
する。
https://www.ema.europa.eu/system/files/documents/report/wc500219991_en.pdf
https://www.ema.europa.eu/system/files/documents/other/wc500219993_en.pdf
通常販売承認に移行
条件付き販売承認
移行の「保留」
商業的理由(commercial reasons)
により販売承認を取下げ
13
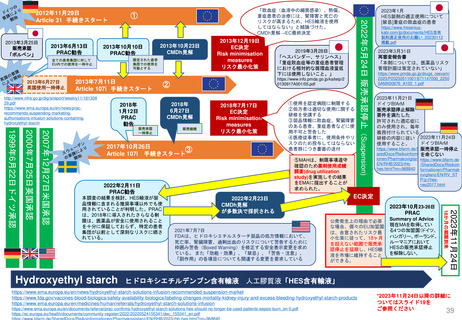
2006年から2016年のEMAによる10年調査より
平均
中央値
“Conditional marketing authorisation Report on ten years of
experience at the European Medicines Agency”
平均4年
特定の義務(Specific Obligations, SOB)を完了
し、通常の販売承認が得られた製品について、
承認が「条件付き」であった期間
(すなわち「切り替え」までの期間)は、
半年から7年強の範囲であった
条件付き販売承認が付与されてから通
常の販売承認に移行するまでの期間
(単位:年、移行した条件付き販売承
認すべて)(N=11)
CHMPは、毎年収集されるすべてのデータ
を検討し、条件付き販売承認のさらなる更
新、または通常の販売承認への移行を決定
する。
https://www.ema.europa.eu/system/files/documents/report/wc500219991_en.pdf
https://www.ema.europa.eu/system/files/documents/other/wc500219993_en.pdf
通常販売承認に移行
条件付き販売承認
移行の「保留」
商業的理由(commercial reasons)
により販売承認を取下げ
13