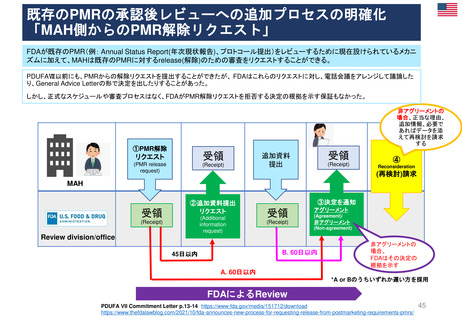
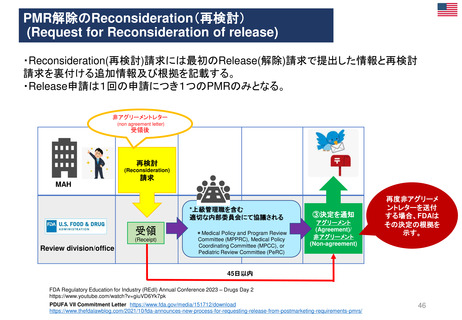
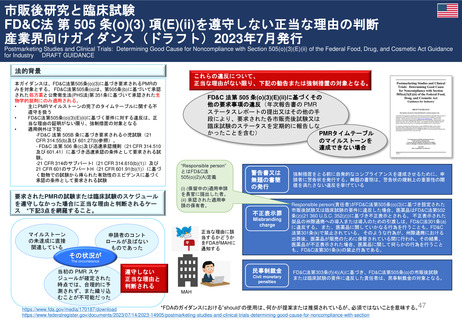
よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (49 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
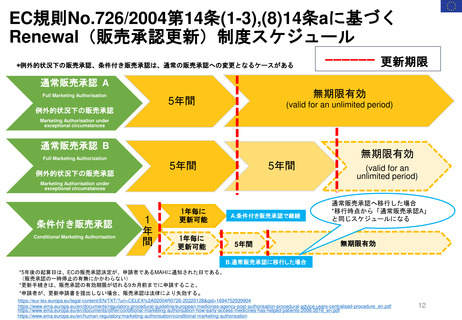
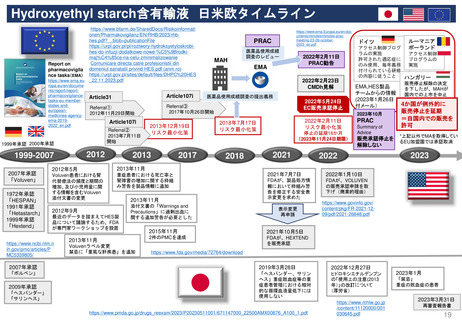
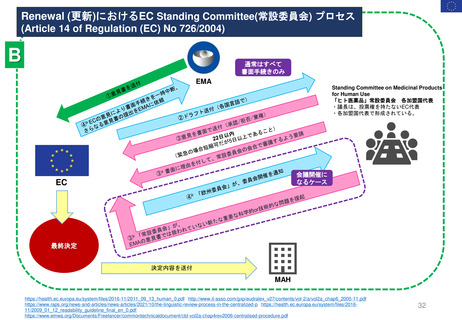
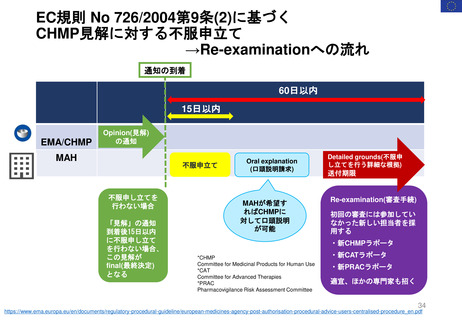
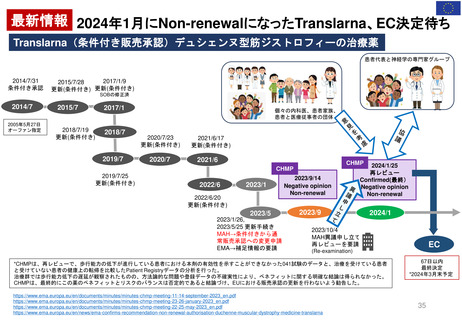
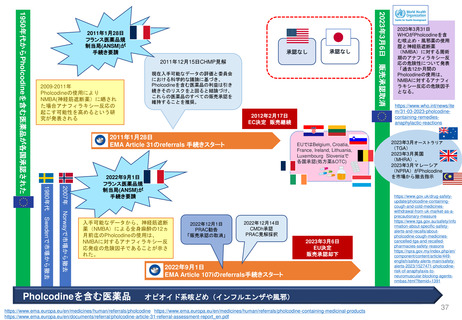
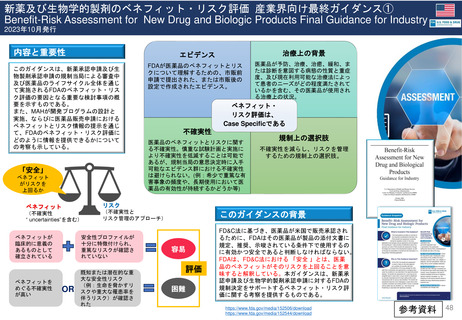
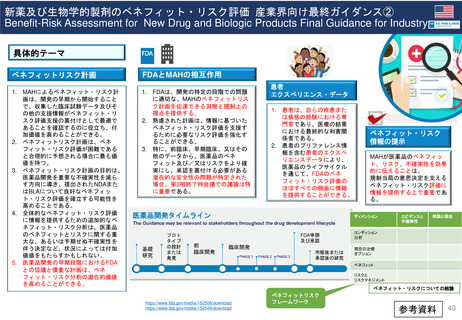
新薬及び生物学的製剤のベネフィット・リスク評価 産業界向け最終ガイダンス②
Benefit-Risk Assessment for New Drug and Biologic Products Final Guidance for Industry
具体的テーマ
ベネフィットリスク計画
FDAとMAHの相互作用
1. MAHによるベネフィット・リスク計
画は、開発の早期から開始すること
で、収集した臨床試験データ及びそ
の他の支援情報がベネフィット・リ
スク評価支援の裏付けとして最適で
あることを確認するのに役立ち、付
加価値を高めることができる。
2. ベネフィットリスク計画は、ベネ
フィット・リスク評価が困難である
と合理的に予想される場合に最も価
値を持つ。
3. ベネフィット・リスク計画の目的は、
医薬品開発を重要な不確実性を減ら
す方向に導き、提出されたNDAまた
はBLAについて良好なベネフィッ
ト・リスク評価を確立する可能性を
高めることである。
4. 全体的なベネフィット・リスク評価
に情報を提供するための追加的なベ
ネフィット・リスク分析は、医薬品
のベネフィットとリスクに関する重
大な、あるいは予期せぬ不確実性を
伴う決定など、状況によっては付加
価値をもたらすかもしれない。
5. 医薬品開発の早期段階におけるFDA
との協議と慎重な計画は、ベネ
フィット・リスク分析の潜在的価値
を高めることができる。
1. FDAは、開発の特定の段階での問題
に適切な、MAHのベネフィットリス
ク計画を伝達できる洞察と規制上の
視点を提供する。
2. 熟慮された計画は、情報に基づいた
ベネフィット・リスク評価を支援す
るために必要なリスク評価を強化す
ることができる。
3. 特に、前臨床、早期臨床、又はその
他のデータから、医薬品のベネ
フィット及び/又はリスクをより確
実にし、承認を裏付ける必要がある
潜在的な安全性の問題が特定された
場合、第2相終了時会議での議論は特
に重要である。
患者
エクスペリエンス・データ
1. 患者は、自らの疾患また
は病態の経験における専
門家であり、医療の結果
における最終的な利害関
係者である。
2. 患者のプリファレンス情
報を含む患者のエクスペ
リエンスデータにより、
医薬品のライフサイクル
を通じて、FDAのベネ
フィット・リスク評価の
ほぼすべての側面に情報
を提供することができる。
医薬品開発タイムライン
基礎
研究
プロト
タイプ
の設計
または
発見
前
臨床開発
ベネフィット・リスク
情報の提示
MAHが医薬品のベネフィッ
ト、リスク、不確実性を効果
的に伝えることは、
規制当局の意思決定を支える
ベネフィット・リスク評価に
情報を提供する上で重要であ
る。
ディメンション
FDA申請
及び承認
臨床開発
市販後または
承認後の研究
エビデンスと
不確実性
結論と理由
コンディション
分析
現在の治療
オプション
ベネフィット
リスクと
リスクマネジメント
ベネフィット・リスクについての結論
https://www.fda.gov/media/152506/download
https://www.fda.gov/media/152544/download
ベネフィットリスク
フレームワーク
参考資料
49
Benefit-Risk Assessment for New Drug and Biologic Products Final Guidance for Industry
具体的テーマ
ベネフィットリスク計画
FDAとMAHの相互作用
1. MAHによるベネフィット・リスク計
画は、開発の早期から開始すること
で、収集した臨床試験データ及びそ
の他の支援情報がベネフィット・リ
スク評価支援の裏付けとして最適で
あることを確認するのに役立ち、付
加価値を高めることができる。
2. ベネフィットリスク計画は、ベネ
フィット・リスク評価が困難である
と合理的に予想される場合に最も価
値を持つ。
3. ベネフィット・リスク計画の目的は、
医薬品開発を重要な不確実性を減ら
す方向に導き、提出されたNDAまた
はBLAについて良好なベネフィッ
ト・リスク評価を確立する可能性を
高めることである。
4. 全体的なベネフィット・リスク評価
に情報を提供するための追加的なベ
ネフィット・リスク分析は、医薬品
のベネフィットとリスクに関する重
大な、あるいは予期せぬ不確実性を
伴う決定など、状況によっては付加
価値をもたらすかもしれない。
5. 医薬品開発の早期段階におけるFDA
との協議と慎重な計画は、ベネ
フィット・リスク分析の潜在的価値
を高めることができる。
1. FDAは、開発の特定の段階での問題
に適切な、MAHのベネフィットリス
ク計画を伝達できる洞察と規制上の
視点を提供する。
2. 熟慮された計画は、情報に基づいた
ベネフィット・リスク評価を支援す
るために必要なリスク評価を強化す
ることができる。
3. 特に、前臨床、早期臨床、又はその
他のデータから、医薬品のベネ
フィット及び/又はリスクをより確
実にし、承認を裏付ける必要がある
潜在的な安全性の問題が特定された
場合、第2相終了時会議での議論は特
に重要である。
患者
エクスペリエンス・データ
1. 患者は、自らの疾患また
は病態の経験における専
門家であり、医療の結果
における最終的な利害関
係者である。
2. 患者のプリファレンス情
報を含む患者のエクスペ
リエンスデータにより、
医薬品のライフサイクル
を通じて、FDAのベネ
フィット・リスク評価の
ほぼすべての側面に情報
を提供することができる。
医薬品開発タイムライン
基礎
研究
プロト
タイプ
の設計
または
発見
前
臨床開発
ベネフィット・リスク
情報の提示
MAHが医薬品のベネフィッ
ト、リスク、不確実性を効果
的に伝えることは、
規制当局の意思決定を支える
ベネフィット・リスク評価に
情報を提供する上で重要であ
る。
ディメンション
FDA申請
及び承認
臨床開発
市販後または
承認後の研究
エビデンスと
不確実性
結論と理由
コンディション
分析
現在の治療
オプション
ベネフィット
リスクと
リスクマネジメント
ベネフィット・リスクについての結論
https://www.fda.gov/media/152506/download
https://www.fda.gov/media/152544/download
ベネフィットリスク
フレームワーク
参考資料
49