よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (45 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
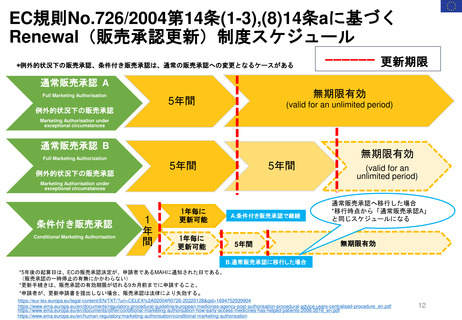
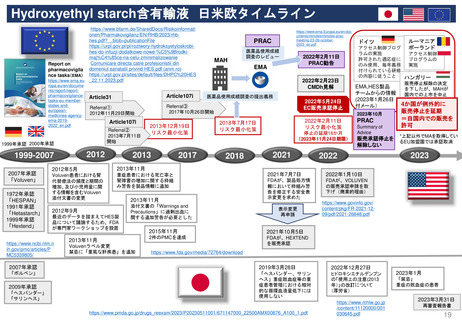
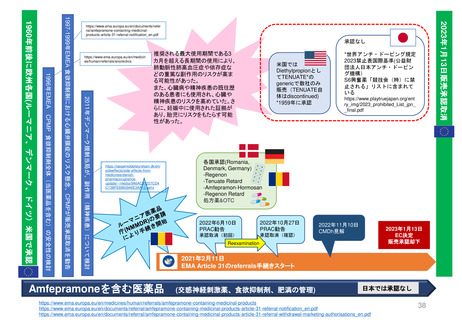
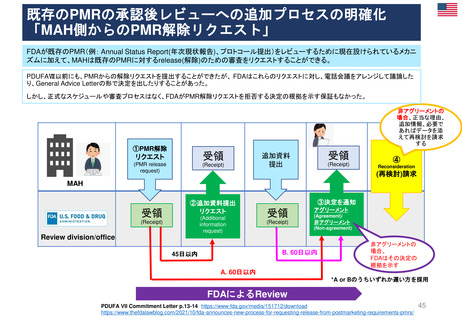
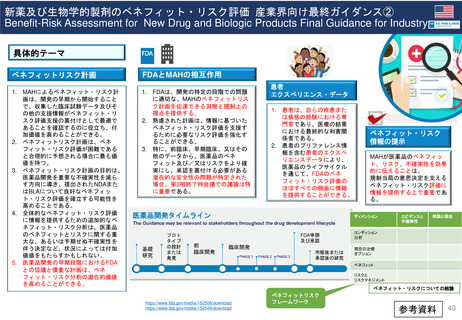
既存のPMRの承認後レビューへの追加プロセスの明確化
「MAH側からのPMR解除リクエスト」
FDAが既存のPMR(例: Annual Status Report(年次現状報告)、プロトコール提出)をレビューするために現在設けられているメカニ
ズムに加えて、MAHは既存のPMRに対するrelease(解除)のための審査をリクエストすることができる。
PDUFAⅦ以前にも、PMRからの解除リクエストを提出することができたが、 FDAはこれらのリクエストに対し、電話会議をアレンジして議論した
り、General Advice Letterの形で決定を出したりすることがあった。
しかし、正式なスケジュールや審査プロセスはなく、FDAがPMR解除リクエストを拒否する決定の根拠を示す保証もなかった。
非アグリーメントの
場合、正当な理由、
追加情報、必要で
あればデータを添
えて再検討を請求
する
①PMR解除
リクエスト
受領
(PMR release
request)
(Receipt)
受領
追加資料
提出
(Receipt)
④
Reconsideration
(再検討)請求
MAH
受領
②追加資料提出
リクエスト
(Additional
information
request)
(Receipt)
③決定を通知
受領
アグリーメント
(Receipt)
非アグリーメント
(Agreement)/
(Non-agreement)
Review division/office
B. 60日以内
45日以内
非アグリーメントの
場合、
FDAはその決定の
根拠を示す
A. 60日以内
*A or Bのうちいずれか遅い方を採用
FDAによるReview
PDUFA VII Commitment Letter p.13-14 https://www.fda.gov/media/151712/download
https://www.thefdalawblog.com/2021/10/fda-announces-new-process-for-requesting-release-from-postmarketing-requirements-pmrs/
45
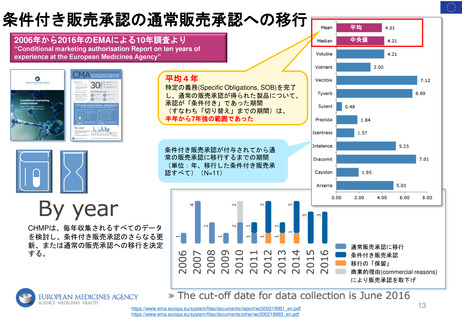
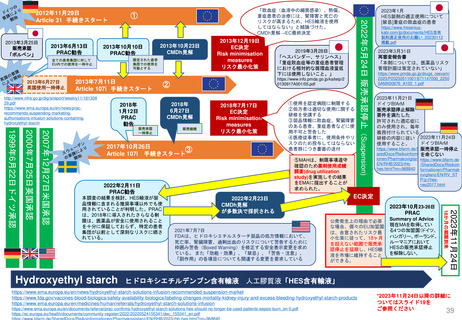
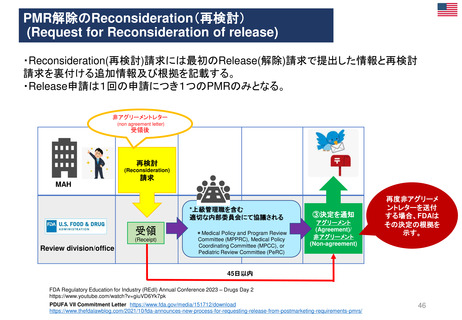
「MAH側からのPMR解除リクエスト」
FDAが既存のPMR(例: Annual Status Report(年次現状報告)、プロトコール提出)をレビューするために現在設けられているメカニ
ズムに加えて、MAHは既存のPMRに対するrelease(解除)のための審査をリクエストすることができる。
PDUFAⅦ以前にも、PMRからの解除リクエストを提出することができたが、 FDAはこれらのリクエストに対し、電話会議をアレンジして議論した
り、General Advice Letterの形で決定を出したりすることがあった。
しかし、正式なスケジュールや審査プロセスはなく、FDAがPMR解除リクエストを拒否する決定の根拠を示す保証もなかった。
非アグリーメントの
場合、正当な理由、
追加情報、必要で
あればデータを添
えて再検討を請求
する
①PMR解除
リクエスト
受領
(PMR release
request)
(Receipt)
受領
追加資料
提出
(Receipt)
④
Reconsideration
(再検討)請求
MAH
受領
②追加資料提出
リクエスト
(Additional
information
request)
(Receipt)
③決定を通知
受領
アグリーメント
(Receipt)
非アグリーメント
(Agreement)/
(Non-agreement)
Review division/office
B. 60日以内
45日以内
非アグリーメントの
場合、
FDAはその決定の
根拠を示す
A. 60日以内
*A or Bのうちいずれか遅い方を採用
FDAによるReview
PDUFA VII Commitment Letter p.13-14 https://www.fda.gov/media/151712/download
https://www.thefdalawblog.com/2021/10/fda-announces-new-process-for-requesting-release-from-postmarketing-requirements-pmrs/
45