よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (41 ページ)
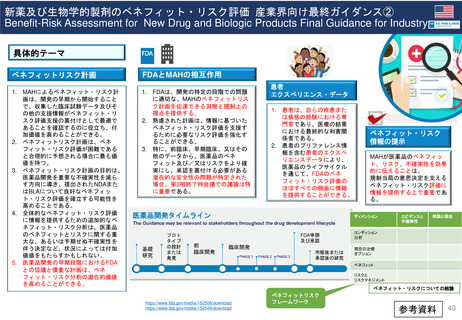
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
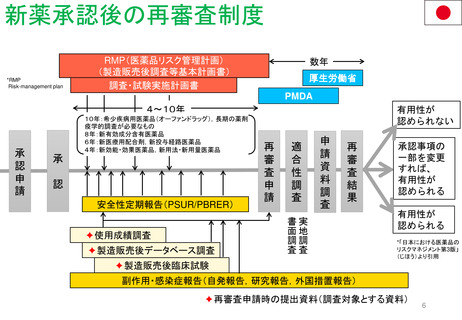
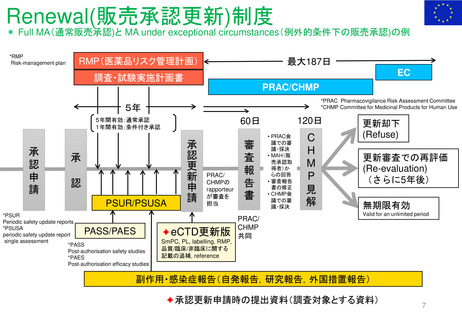
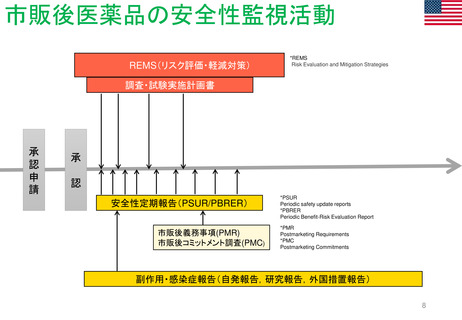
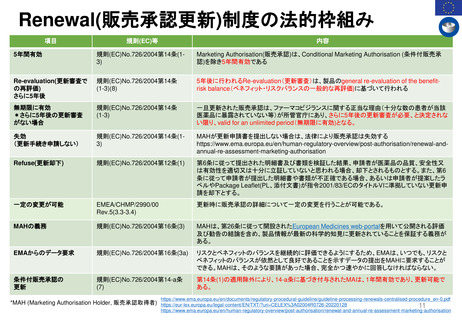
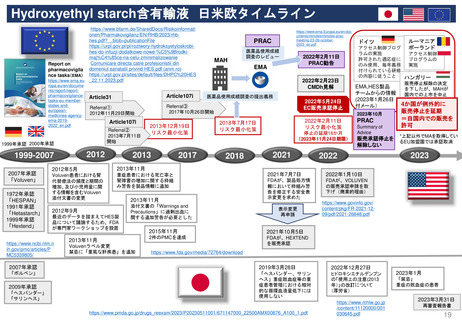
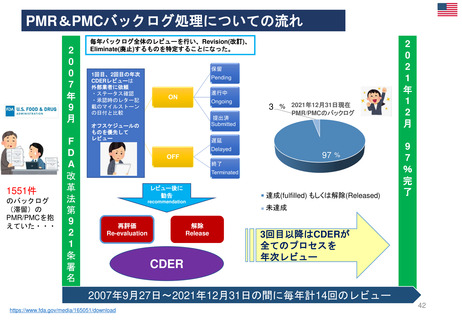
FDA改革法(2007年)成立前後のPMR/PMCバックログ(滞留・未処理分)
以前
総称として Postmarketing Commitments (市販後コミットメント)
と呼ばれ、安全性とそれ以外(例:有効性)の問題に対処した
PMR/PMCが混在していた。
PMR/PMCについての明確な定義なし。全ての市販後研究及び臨床試験(要求され
たもの及び同意したもの)は 「市販後コミットメント 」と呼ばれていた。 従って、市販
後コミットメントのバックログには、要求された試験や臨床試験だけでなく、申請者が
実施することに同意したが、実施することを要求されなかった試験/臨床試験も含
まれた。
第1回のバックログレビューでは1551件
のバックログを抱えていた。
FDA改革法以前、FDAは以下の試験や臨床試験を要求することがで
きた。
• 21 CFR 314.510及び21 CFR 601.41の迅速承認要件の下で承認さ
れた医薬品のクリニカルベネフィットを証明するための市販後試
験または臨床試験
• 小児研究衡平法(Pediatric Research Equity Act:PREA)に基づ
き要求される、延期された小児試験(21 CFR 314.55(b)及び
601.27(b))
• Animal Efficacy Rule (21 CFR 314.610(b)(1)及び601.91(b)(1))
に基づき承認された製品の使用時に実施しなければならないヒト
における安全性及び有効性を証明するための試験または臨床試験
F
D
A
改
革
法
成
立
以後
PMRとPMCの用語の明確化と、安全性の問題
に特化したPMR/PMCを特定した。
PMRは、 Required(要求された)
PMCは、 Agreed(合意された)
研究と臨床試験であると、用語を明確に区別した。
FDA改革法以前にリリース、履行されていないことが条
件である。
FDA改革法により市販後試験及び臨床試験は以下の目的
においても要求されることになった。
• 医薬品の使用に関連する既知の重大なリスクの評価
• 医薬品の使用に関連した重篤なリスクのシグナルを
評価する。
• 入手可能なデータが重篤なリスクの可能性を示して
いる場合、予期せぬ重篤なリスクを特定する。
議会報告
市販後義務調査(PMR)と
市販後コミットメント調査
(PMC)のバックログに関する
第14回レビュー
Report to Congress
The Fourteenth Review of
the Backlog of
Postmarketing Requirements
and Commitments
*2007年から2021年の14年分
のバックログの状況を報告
FDA 2021年12月31日
https://www.fda.gov/media/165051/download
https://www.fda.gov/media/143984/download
https://www.fda.gov/drugs/guidance-compliance-regulatory-information/postmarket-requirements-and-commitments
41
以前
総称として Postmarketing Commitments (市販後コミットメント)
と呼ばれ、安全性とそれ以外(例:有効性)の問題に対処した
PMR/PMCが混在していた。
PMR/PMCについての明確な定義なし。全ての市販後研究及び臨床試験(要求され
たもの及び同意したもの)は 「市販後コミットメント 」と呼ばれていた。 従って、市販
後コミットメントのバックログには、要求された試験や臨床試験だけでなく、申請者が
実施することに同意したが、実施することを要求されなかった試験/臨床試験も含
まれた。
第1回のバックログレビューでは1551件
のバックログを抱えていた。
FDA改革法以前、FDAは以下の試験や臨床試験を要求することがで
きた。
• 21 CFR 314.510及び21 CFR 601.41の迅速承認要件の下で承認さ
れた医薬品のクリニカルベネフィットを証明するための市販後試
験または臨床試験
• 小児研究衡平法(Pediatric Research Equity Act:PREA)に基づ
き要求される、延期された小児試験(21 CFR 314.55(b)及び
601.27(b))
• Animal Efficacy Rule (21 CFR 314.610(b)(1)及び601.91(b)(1))
に基づき承認された製品の使用時に実施しなければならないヒト
における安全性及び有効性を証明するための試験または臨床試験
F
D
A
改
革
法
成
立
以後
PMRとPMCの用語の明確化と、安全性の問題
に特化したPMR/PMCを特定した。
PMRは、 Required(要求された)
PMCは、 Agreed(合意された)
研究と臨床試験であると、用語を明確に区別した。
FDA改革法以前にリリース、履行されていないことが条
件である。
FDA改革法により市販後試験及び臨床試験は以下の目的
においても要求されることになった。
• 医薬品の使用に関連する既知の重大なリスクの評価
• 医薬品の使用に関連した重篤なリスクのシグナルを
評価する。
• 入手可能なデータが重篤なリスクの可能性を示して
いる場合、予期せぬ重篤なリスクを特定する。
議会報告
市販後義務調査(PMR)と
市販後コミットメント調査
(PMC)のバックログに関する
第14回レビュー
Report to Congress
The Fourteenth Review of
the Backlog of
Postmarketing Requirements
and Commitments
*2007年から2021年の14年分
のバックログの状況を報告
FDA 2021年12月31日
https://www.fda.gov/media/165051/download
https://www.fda.gov/media/143984/download
https://www.fda.gov/drugs/guidance-compliance-regulatory-information/postmarket-requirements-and-commitments
41