よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (30 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
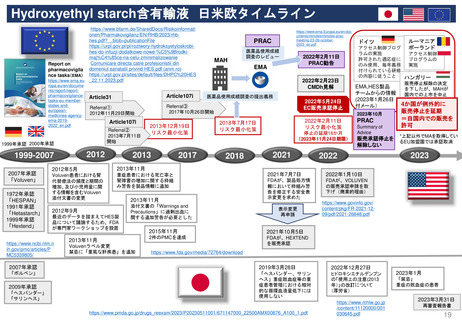
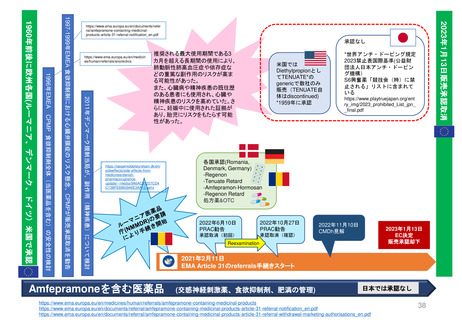
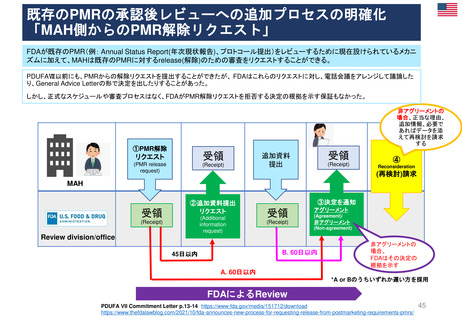
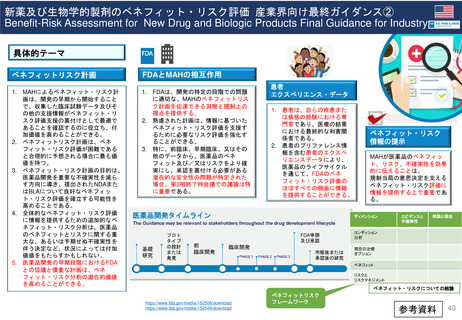
加盟国文書レビュー患者参画
患者参画
PLレビュープロセス(流れ)
提出から5日目~19日目の流れ
A
患者・消費者団体
(Patient Consumer
Organisation, PCO)
コーディネーター
EMA Medical Information
Sector(MIS)
患者・消費者団体(PCO)代表と
の連絡を担当
PL最終版を情報
として受領する
EMA & QRD
サブグループミーティング
⑥PLの検証
CHMP
EMA
PLを受領し見解(opinion)
の一部として採用する
Quality Review of
Documents (QRD)
Working Group
文書品質レビュー
ワーキンググループ
Labeling review and
standards(LRS)
EMAのヒト医薬品部門
Human medicine evaluation
division
https://www.ema.europa.e
u/en/documents/other/org
anisation-chart-humanmedicines_en.pdf
MAH
*PL Package Leaflet (添付文書)
加盟国のアセッサー(Assessors)
(もう少し科学的レビューが
必要な場合)
*2014 EMA Training Session資料を参考に作成
https://www.ema.europa.eu/en/events/training-session-patients-consumers-involved-european-medicines-agency-activities
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/procedure-review-information-medicinal-products-patients-consumers-organisations_en.pdf
https://www.legislation.gov.uk/eudr/2004/27/pdfs/eudr_20040027_adopted_en.pdf
https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:02001L0083-20220101
30
https://www.ema.europa.eu/en/documents/presentation/presentation-what-package-leaflet-how-review-it-claire-espinasse_en-0.pdf
https://health.ec.europa.eu/system/files/2016-11/2009_01_12_readability_guideline_final_en_0.pdf
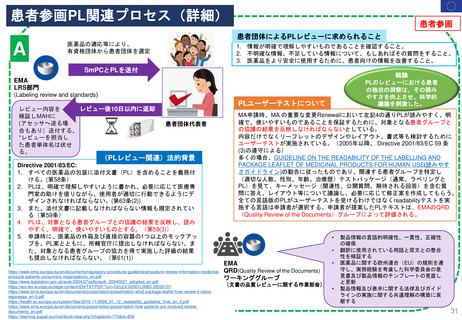
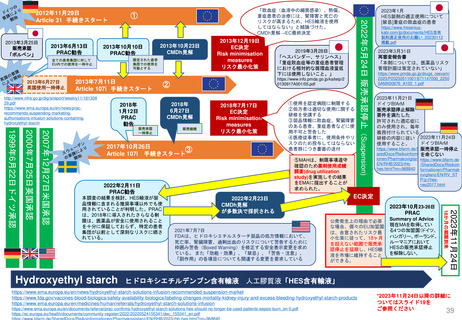
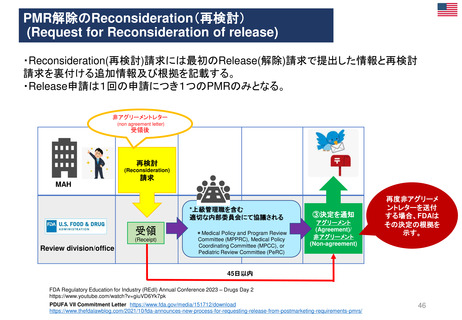
患者参画
PLレビュープロセス(流れ)
提出から5日目~19日目の流れ
A
患者・消費者団体
(Patient Consumer
Organisation, PCO)
コーディネーター
EMA Medical Information
Sector(MIS)
患者・消費者団体(PCO)代表と
の連絡を担当
PL最終版を情報
として受領する
EMA & QRD
サブグループミーティング
⑥PLの検証
CHMP
EMA
PLを受領し見解(opinion)
の一部として採用する
Quality Review of
Documents (QRD)
Working Group
文書品質レビュー
ワーキンググループ
Labeling review and
standards(LRS)
EMAのヒト医薬品部門
Human medicine evaluation
division
https://www.ema.europa.e
u/en/documents/other/org
anisation-chart-humanmedicines_en.pdf
MAH
*PL Package Leaflet (添付文書)
加盟国のアセッサー(Assessors)
(もう少し科学的レビューが
必要な場合)
*2014 EMA Training Session資料を参考に作成
https://www.ema.europa.eu/en/events/training-session-patients-consumers-involved-european-medicines-agency-activities
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/procedure-review-information-medicinal-products-patients-consumers-organisations_en.pdf
https://www.legislation.gov.uk/eudr/2004/27/pdfs/eudr_20040027_adopted_en.pdf
https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:02001L0083-20220101
30
https://www.ema.europa.eu/en/documents/presentation/presentation-what-package-leaflet-how-review-it-claire-espinasse_en-0.pdf
https://health.ec.europa.eu/system/files/2016-11/2009_01_12_readability_guideline_final_en_0.pdf