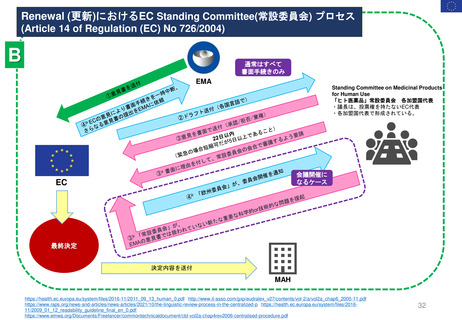
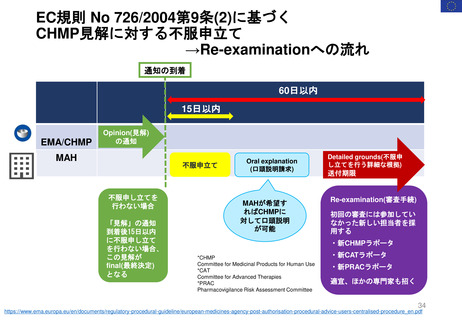
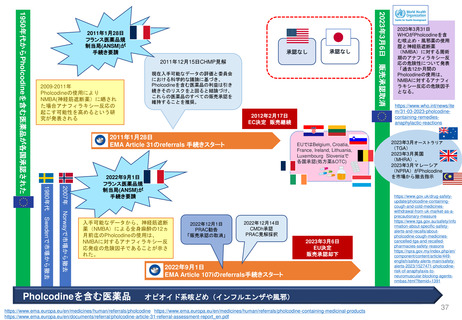
よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (35 ページ)
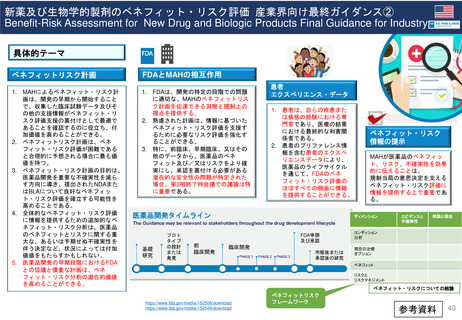
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
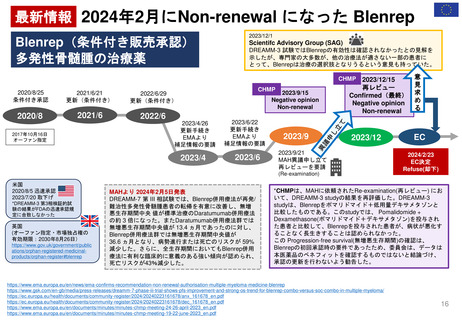
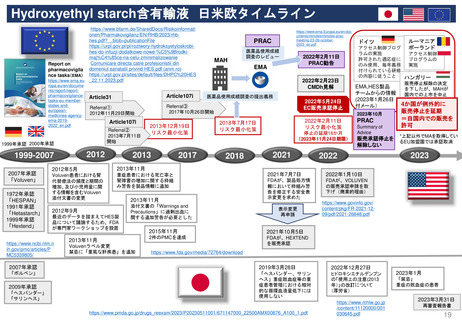
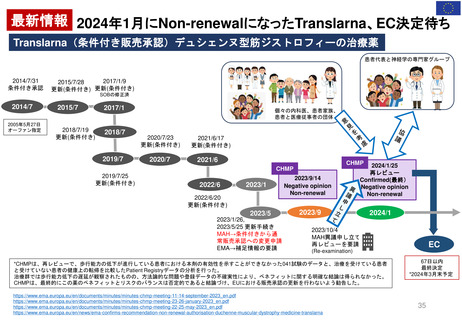
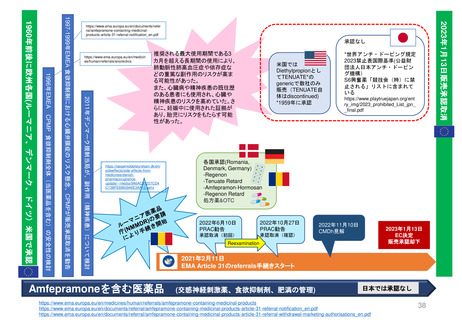
最新情報 2024年1月にNon-renewalになったTranslarna、EC決定待ち
Translarna(条件付き販売承認)デュシェンヌ型筋ジストロフィーの治療薬
患者代表と神経学の専門家グループ
2014/7/31
条件付き承認
2017/1/9
2015/7/28
更新(条件付き) 更新(条件付き)
SOBの修正済
2014/7
2005年5月27日
オーファン指定
2015/7
2017/1
2018/7/19
更新(条件付き)
2018/7
2019/7
個々の内科医、患者家族、
患者と医療従事者の団体
2020/7/23
更新(条件付き)
2021/6/17
更新(条件付き)
2020/7
2021/6
CHMP
CHMP
2019/7/25
更新(条件付き)
2022/6
2023/1
2022/6/20
更新(条件付き)
2023/5
2023/1/26,
2023/5/25 更新手続き
MAH→条件付きから通
常販売承認への変更申請
EMA→補足情報の要請
2023/9/14
Negative opinion
Non-renewal
2024/1/25
再レビュー
Confirmed(最終)
Negative opinion
Non-renewal
2023/9
2024/1
2023/10/4
MAH異議申し立て
再レビューを要請
EC
(Re-examination)
*CHMPは、再レビューで、歩行能力の低下が進行している患者における本剤の有効性を示すことができなかった041試験のデータと、治療を受けている患者
と受けていない患者の健康上の転帰を比較したPatient Registryデータの分析を行った。
治療群では歩行能力低下の遅延が観察されたものの、方法論的な問題や登録データの不確実性により、ベネフィットに関する明確な結論は得られなかった。
CHMPは、最終的にこの薬のベネフィットとリスクのバランスは否定的であると結論づけ、EUにおける販売承認の更新を行わないよう勧告した。
https://www.ema.europa.eu/en/documents/minutes/minutes-chmp-meeting-11-14-september-2023_en.pdf
https://www.ema.europa.eu/en/documents/minutes/minutes-chmp-meeting-23-26-january-2023_en.pdf
https://www.ema.europa.eu/en/documents/minutes/minutes-chmp-meeting-22-25-may-2023_en.pdf
https://www.ema.europa.eu/en/news/ema-confirms-recommendation-non-renewal-authorisation-duchenne-muscular-dystrophy-medicine-translarna
67日以内
最終決定
*2024年3月末予定
35
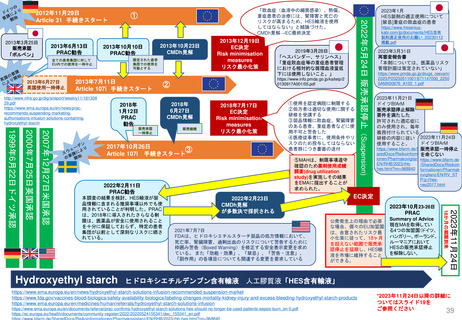
Translarna(条件付き販売承認)デュシェンヌ型筋ジストロフィーの治療薬
患者代表と神経学の専門家グループ
2014/7/31
条件付き承認
2017/1/9
2015/7/28
更新(条件付き) 更新(条件付き)
SOBの修正済
2014/7
2005年5月27日
オーファン指定
2015/7
2017/1
2018/7/19
更新(条件付き)
2018/7
2019/7
個々の内科医、患者家族、
患者と医療従事者の団体
2020/7/23
更新(条件付き)
2021/6/17
更新(条件付き)
2020/7
2021/6
CHMP
CHMP
2019/7/25
更新(条件付き)
2022/6
2023/1
2022/6/20
更新(条件付き)
2023/5
2023/1/26,
2023/5/25 更新手続き
MAH→条件付きから通
常販売承認への変更申請
EMA→補足情報の要請
2023/9/14
Negative opinion
Non-renewal
2024/1/25
再レビュー
Confirmed(最終)
Negative opinion
Non-renewal
2023/9
2024/1
2023/10/4
MAH異議申し立て
再レビューを要請
EC
(Re-examination)
*CHMPは、再レビューで、歩行能力の低下が進行している患者における本剤の有効性を示すことができなかった041試験のデータと、治療を受けている患者
と受けていない患者の健康上の転帰を比較したPatient Registryデータの分析を行った。
治療群では歩行能力低下の遅延が観察されたものの、方法論的な問題や登録データの不確実性により、ベネフィットに関する明確な結論は得られなかった。
CHMPは、最終的にこの薬のベネフィットとリスクのバランスは否定的であると結論づけ、EUにおける販売承認の更新を行わないよう勧告した。
https://www.ema.europa.eu/en/documents/minutes/minutes-chmp-meeting-11-14-september-2023_en.pdf
https://www.ema.europa.eu/en/documents/minutes/minutes-chmp-meeting-23-26-january-2023_en.pdf
https://www.ema.europa.eu/en/documents/minutes/minutes-chmp-meeting-22-25-may-2023_en.pdf
https://www.ema.europa.eu/en/news/ema-confirms-recommendation-non-renewal-authorisation-duchenne-muscular-dystrophy-medicine-translarna
67日以内
最終決定
*2024年3月末予定
35