よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (43 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
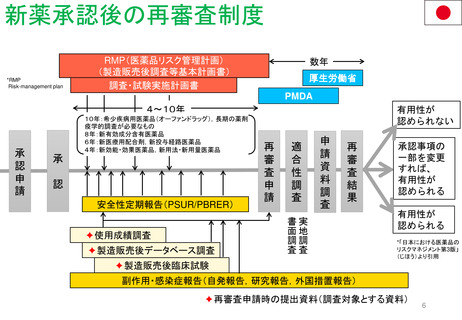
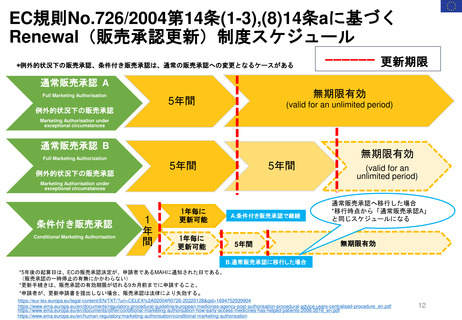
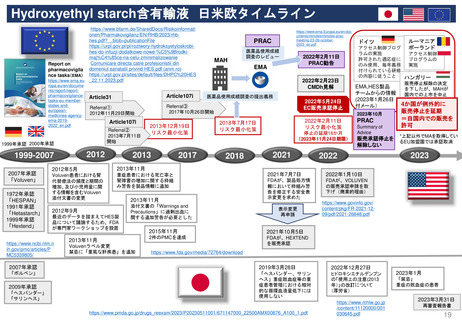
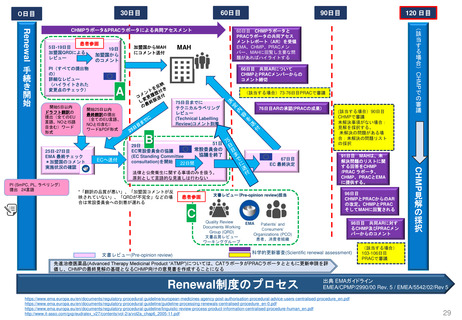
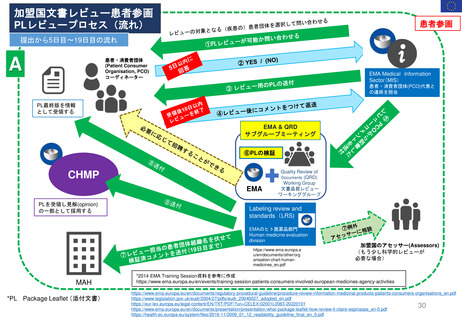
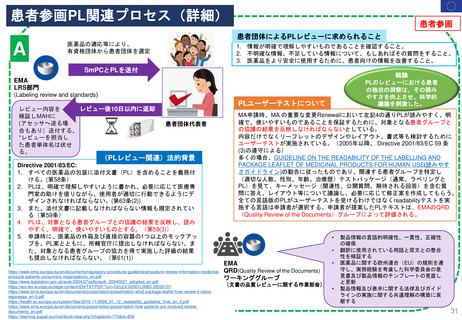
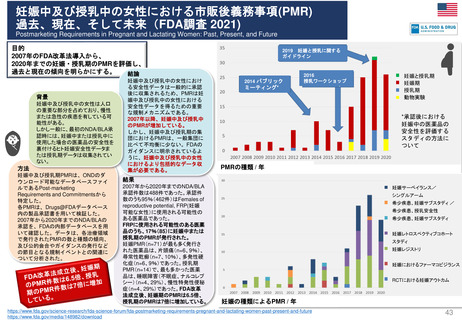
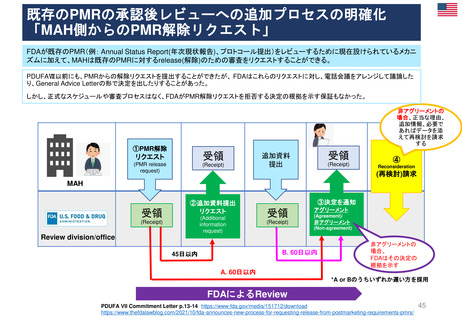
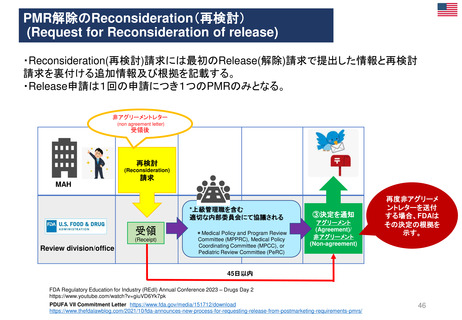
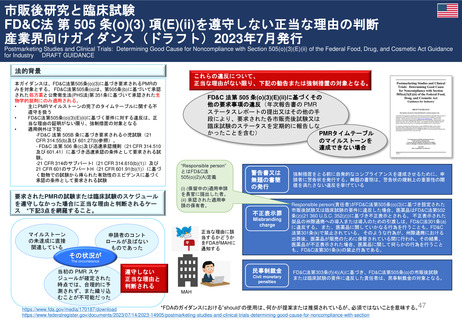
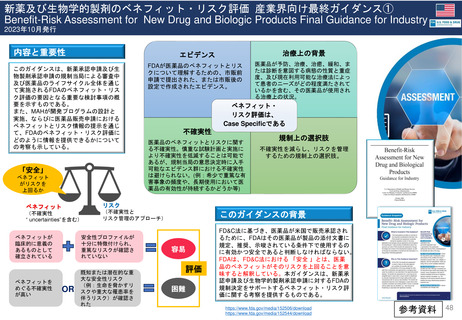
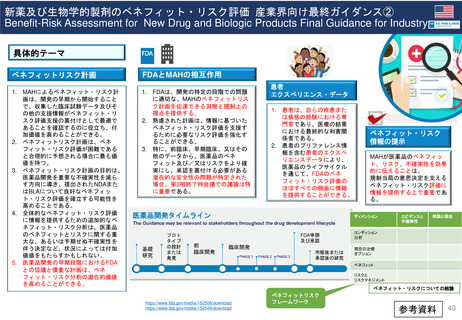
妊娠中及び授乳中の女性における市販後義務事項(PMR)
過去、現在、そして未来(FDA調査 2021)
Postmarketing Requirements in Pregnant and Lactating Women: Past, Present, and Future
目的
2007年のFDA改革法導入から、
2020年までの妊娠・授乳期のPMRを評価し、
過去と現在の傾向を明らかにする。
結論
背景
妊娠中及び授乳中の女性は人口
の重要な部分を占めており、慢性
または急性の疾患を有している可
能性がある。
しかし一般に、最初のNDA/BLA承
認時には、妊娠中または授乳中に
使用した場合の医薬品の安全性を
裏付けるヒト妊娠安全性データま
たは授乳期データは収集されてい
ない。
方法
妊娠中及び授乳期PMRは、ONDのダ
ウンロード可能なデータベースファイ
ルであるPost-marketing
Requirements and Commitmentsから
特定した。
各PMRは、Drugs@FDAデータベース
内の製品承認書を用いて検証した。
2007年から2020年までのNDA/BLAの
承認を、FDAの内部データベースを用
いて確認した。データは、各治療領域
で発行されたPMRの数と種類の傾向、
及び公的会合やガイダンスの発行など
の節目となる規制イベントとの関連に
ついて分析された。
妊娠中及び授乳中の女性におけ
る安全性データは一般的に承認
後に収集されるため、PMRは妊
娠中及び授乳中の女性における
安全性データを得るための重要
な規制メカニズムである。
2007年以降、妊娠中及び授乳中
のPMRが増加している。
しかし、妊娠中及び授乳期の集
団におけるPMRは、一般集団に
比べて不均衡に少ない。FDAの
ガイダンスに明示されているよ
うに、妊娠中及び授乳中の女性
におけるより包括的なデータ収
集が必要である。
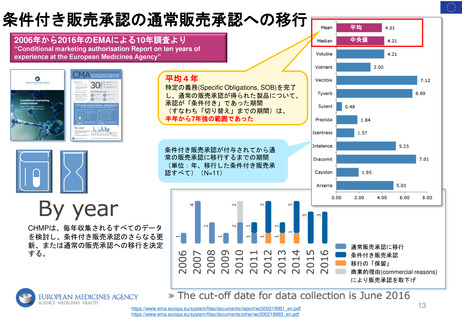
2019 妊娠と授乳に関する
ガイドライン
2014 パブリック
2016
授乳ワークショップ
ミーティング*
妊娠と授乳期
妊娠期
授乳期
動物実験
*承認後における
妊娠中の医薬品の
安全性を評価する
スタディの方法に
ついて
PMRの種類 / 年
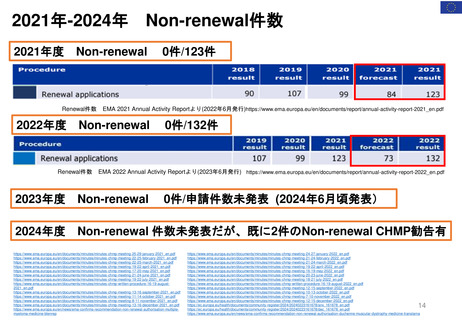
結果
2007年から2020年までのNDA/BLA
承認件数は488件であった。承認件
数のうち95%(462件)はFemales of
reproductive potential, FRP(妊娠
可能な女性)に使用される可能性の
ある医薬品であった。
FRPに使用される可能性のある医薬
品のうち、17%(85)に妊娠中または
授乳期のPMRが発行された。
妊娠PMR(n=71)が最も多く発行さ
れた医薬品は、片頭痛(n=6、9%)、
尋常性乾癬(n=7、10%)、多発性硬
化症(n=6、9%)であった。授乳期
PMR(n=14)で、最も多かった医薬
品は、睡眠障害(不眠症、ナルコレプ
シー)(n=4、29%)、慢性特発性便秘
症(n=4、29%)であった。FDA改革
法成立後、妊娠期のPMRは6.5倍、
授乳期のPMRは7倍に増加している。
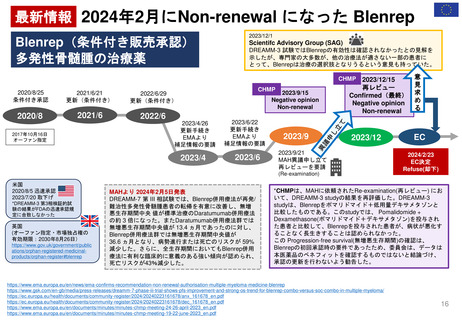
妊娠サーベイランス/
シングルアーム
希少疾患、妊娠サブスタディ /
希少疾患、授乳安全性
希少疾患、妊娠サブスタディ
妊娠レトロスペクティブコホート
スタディ
妊娠レジストリ
妊娠におけるファーマコビジランス
RCTにおける妊娠アウトカム
妊娠の種類によるPMR / 年
https://www.fda.gov/science-research/fda-science-forum/fda-postmarketing-requirements-pregnant-and-lactating-women-past-present-and-future
https://www.fda.gov/media/148982/download
43
過去、現在、そして未来(FDA調査 2021)
Postmarketing Requirements in Pregnant and Lactating Women: Past, Present, and Future
目的
2007年のFDA改革法導入から、
2020年までの妊娠・授乳期のPMRを評価し、
過去と現在の傾向を明らかにする。
結論
背景
妊娠中及び授乳中の女性は人口
の重要な部分を占めており、慢性
または急性の疾患を有している可
能性がある。
しかし一般に、最初のNDA/BLA承
認時には、妊娠中または授乳中に
使用した場合の医薬品の安全性を
裏付けるヒト妊娠安全性データま
たは授乳期データは収集されてい
ない。
方法
妊娠中及び授乳期PMRは、ONDのダ
ウンロード可能なデータベースファイ
ルであるPost-marketing
Requirements and Commitmentsから
特定した。
各PMRは、Drugs@FDAデータベース
内の製品承認書を用いて検証した。
2007年から2020年までのNDA/BLAの
承認を、FDAの内部データベースを用
いて確認した。データは、各治療領域
で発行されたPMRの数と種類の傾向、
及び公的会合やガイダンスの発行など
の節目となる規制イベントとの関連に
ついて分析された。
妊娠中及び授乳中の女性におけ
る安全性データは一般的に承認
後に収集されるため、PMRは妊
娠中及び授乳中の女性における
安全性データを得るための重要
な規制メカニズムである。
2007年以降、妊娠中及び授乳中
のPMRが増加している。
しかし、妊娠中及び授乳期の集
団におけるPMRは、一般集団に
比べて不均衡に少ない。FDAの
ガイダンスに明示されているよ
うに、妊娠中及び授乳中の女性
におけるより包括的なデータ収
集が必要である。
2019 妊娠と授乳に関する
ガイドライン
2014 パブリック
2016
授乳ワークショップ
ミーティング*
妊娠と授乳期
妊娠期
授乳期
動物実験
*承認後における
妊娠中の医薬品の
安全性を評価する
スタディの方法に
ついて
PMRの種類 / 年
結果
2007年から2020年までのNDA/BLA
承認件数は488件であった。承認件
数のうち95%(462件)はFemales of
reproductive potential, FRP(妊娠
可能な女性)に使用される可能性の
ある医薬品であった。
FRPに使用される可能性のある医薬
品のうち、17%(85)に妊娠中または
授乳期のPMRが発行された。
妊娠PMR(n=71)が最も多く発行さ
れた医薬品は、片頭痛(n=6、9%)、
尋常性乾癬(n=7、10%)、多発性硬
化症(n=6、9%)であった。授乳期
PMR(n=14)で、最も多かった医薬
品は、睡眠障害(不眠症、ナルコレプ
シー)(n=4、29%)、慢性特発性便秘
症(n=4、29%)であった。FDA改革
法成立後、妊娠期のPMRは6.5倍、
授乳期のPMRは7倍に増加している。
妊娠サーベイランス/
シングルアーム
希少疾患、妊娠サブスタディ /
希少疾患、授乳安全性
希少疾患、妊娠サブスタディ
妊娠レトロスペクティブコホート
スタディ
妊娠レジストリ
妊娠におけるファーマコビジランス
RCTにおける妊娠アウトカム
妊娠の種類によるPMR / 年
https://www.fda.gov/science-research/fda-science-forum/fda-postmarketing-requirements-pregnant-and-lactating-women-past-present-and-future
https://www.fda.gov/media/148982/download
43