よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
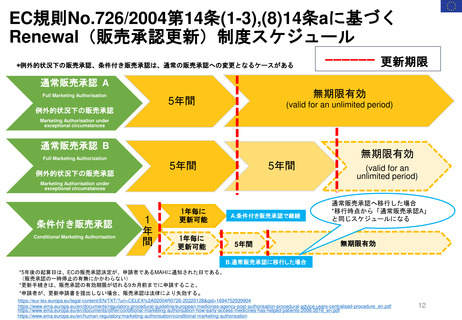
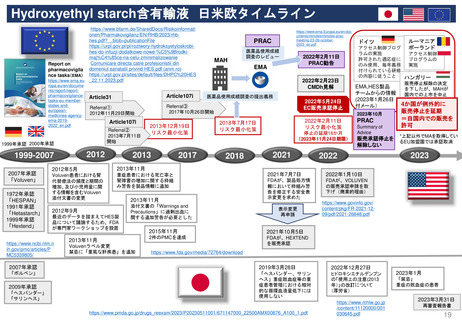
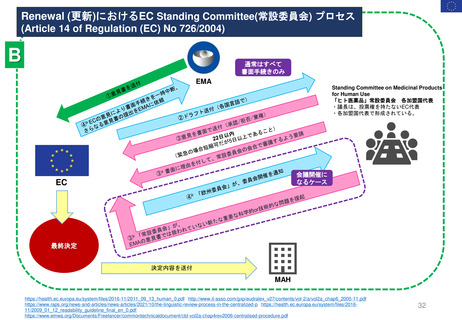
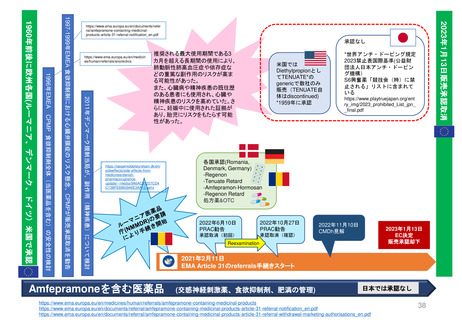
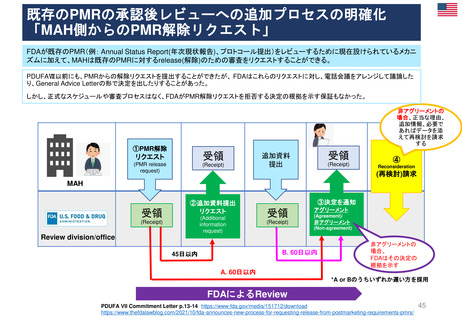
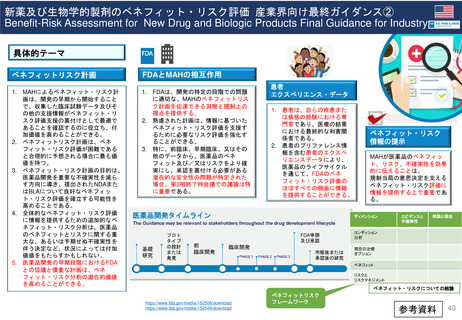
EC規則 No 726/2004第9条(2)に基づく
CHMP見解に対する不服申立て
→Re-examinationへの流れ
通知の到着
60日以内
15日以内
EMA/CHMP
Opinion(見解)
の通知
MAH
不服申立て
不服申し立てを
行わない場合
「見解」の通知
到着後15日以内
に不服申し立て
を行わない場合、
この見解が
final(最終決定)
となる
Oral explanation
(口頭説明請求)
MAHが希望す
ればCHMPに
対して口頭説明
が可能
Detailed grounds(不服申
し立てを行う詳細な根拠)
送付期限
Re-examination(審査手続)
初回の審査には参加してい
なかった新しい担当者を採
用する
・新CHMPラポータ
*CHMP
Committee for Medicinal Products for Human Use
*CAT
Committee for Advanced Therapies
*PRAC
Pharmacovigilance Risk Assessment Committee
・新CATラポータ
・新PRACラポータ
適宜、ほかの専門家も招く
34
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/european-medicines-agency-post-authorisation-procedural-advice-users-centralised-procedure_en.pdf
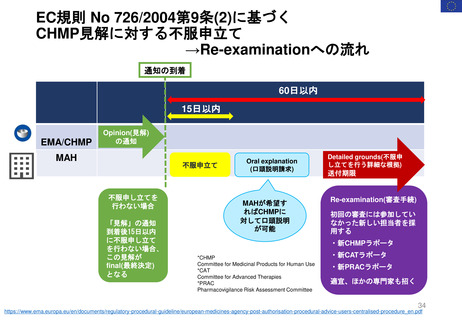
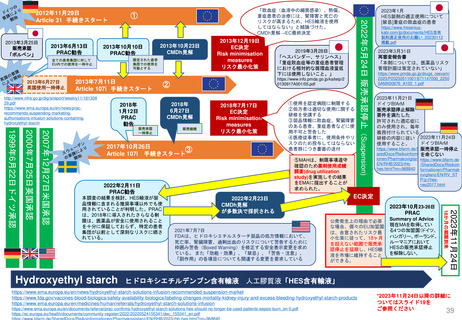
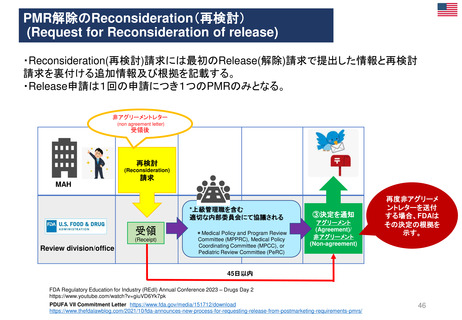
CHMP見解に対する不服申立て
→Re-examinationへの流れ
通知の到着
60日以内
15日以内
EMA/CHMP
Opinion(見解)
の通知
MAH
不服申立て
不服申し立てを
行わない場合
「見解」の通知
到着後15日以内
に不服申し立て
を行わない場合、
この見解が
final(最終決定)
となる
Oral explanation
(口頭説明請求)
MAHが希望す
ればCHMPに
対して口頭説明
が可能
Detailed grounds(不服申
し立てを行う詳細な根拠)
送付期限
Re-examination(審査手続)
初回の審査には参加してい
なかった新しい担当者を採
用する
・新CHMPラポータ
*CHMP
Committee for Medicinal Products for Human Use
*CAT
Committee for Advanced Therapies
*PRAC
Pharmacovigilance Risk Assessment Committee
・新CATラポータ
・新PRACラポータ
適宜、ほかの専門家も招く
34
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/european-medicines-agency-post-authorisation-procedural-advice-users-centralised-procedure_en.pdf