よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (26 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
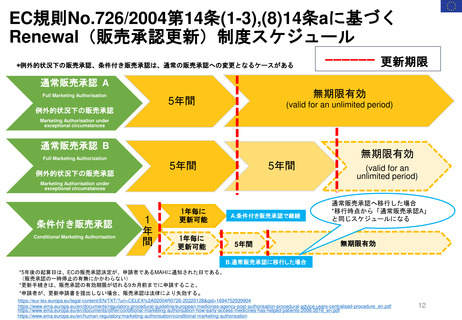
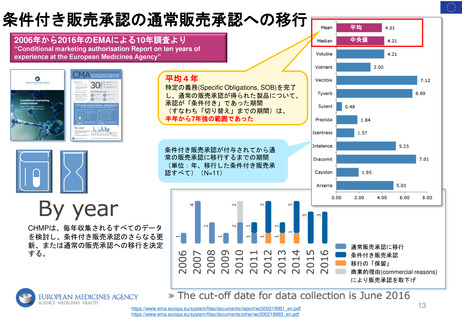
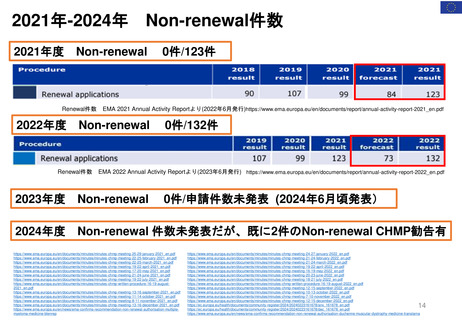
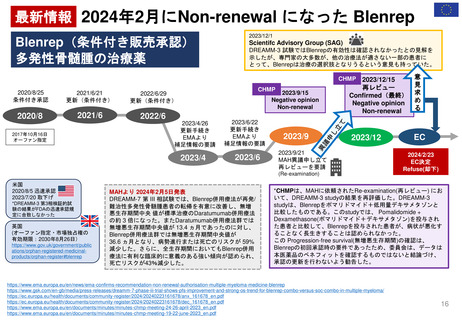
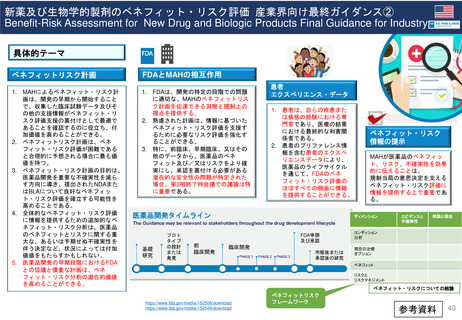
4. 日本の再評価制度に相当する
FDAの制度の有無
薬効再評価の
実施 (DESI)が
相当する?
DESIは、
1938年~1962年に安全
性のみを評価して承認され
た医薬品の有効性を検討
する行政施策
1962年に連邦食品・医薬品・化粧品法( FD&C法:1938年~)が改正され
(Kefauver-Harris改正)、FDAの承認を得るためには新薬の有効性を示
すことが義務付けられた。この改正で、1938年~1962年に安全性のみで
承認された医薬品の薬効再評価の実施が定められた。
➢ DESI手続きは現在ほとんど終了している
➢ FDAの調査結果は官報に掲載されている
26
https://www.fda.gov/drugs/enforcement-activities-fda/drug-efficacy-study-implementation-desi
FDAの制度の有無
薬効再評価の
実施 (DESI)が
相当する?
DESIは、
1938年~1962年に安全
性のみを評価して承認され
た医薬品の有効性を検討
する行政施策
1962年に連邦食品・医薬品・化粧品法( FD&C法:1938年~)が改正され
(Kefauver-Harris改正)、FDAの承認を得るためには新薬の有効性を示
すことが義務付けられた。この改正で、1938年~1962年に安全性のみで
承認された医薬品の薬効再評価の実施が定められた。
➢ DESI手続きは現在ほとんど終了している
➢ FDAの調査結果は官報に掲載されている
26
https://www.fda.gov/drugs/enforcement-activities-fda/drug-efficacy-study-implementation-desi