よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (40 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
詳細情報・目次
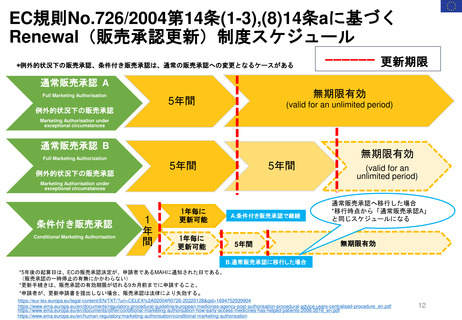
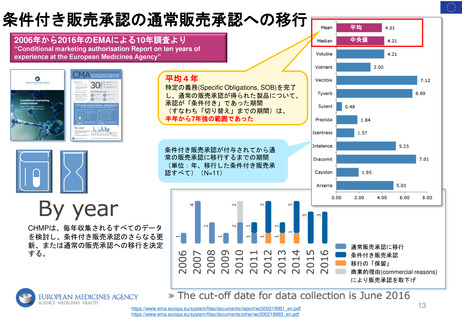
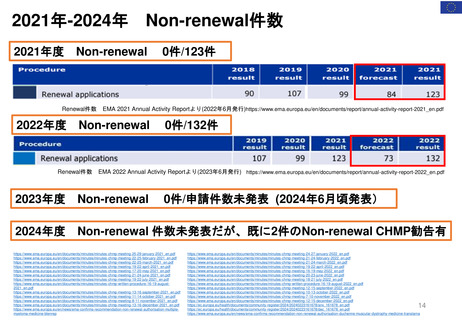
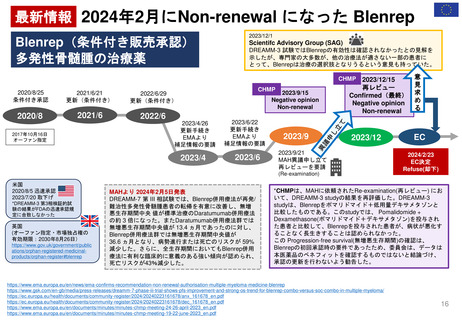
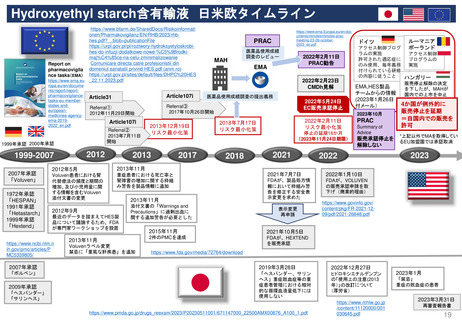
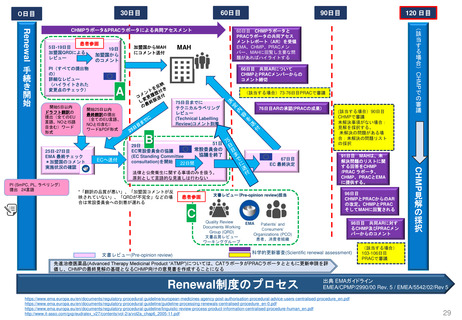
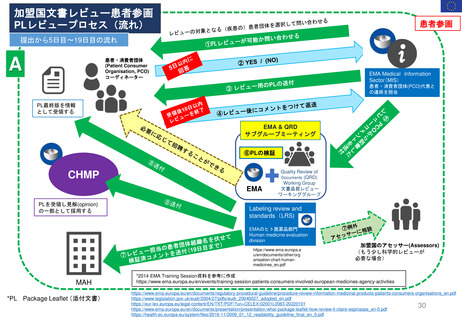
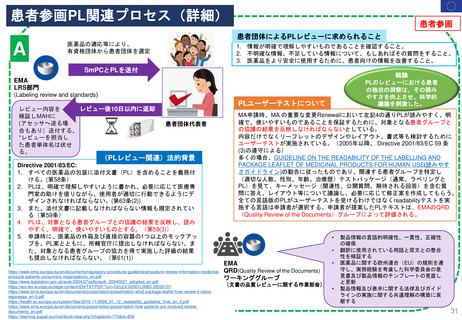
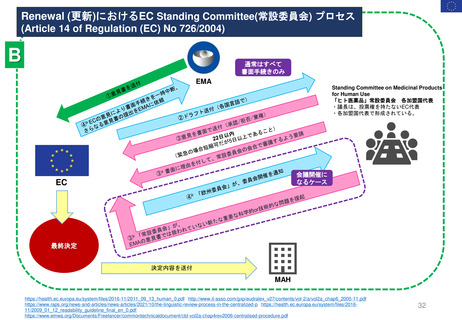
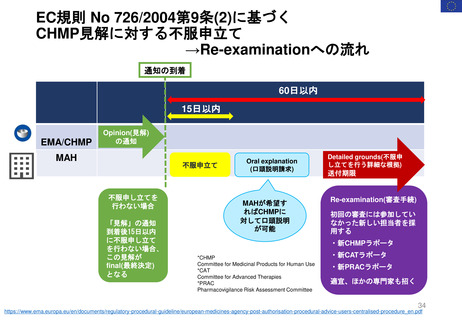
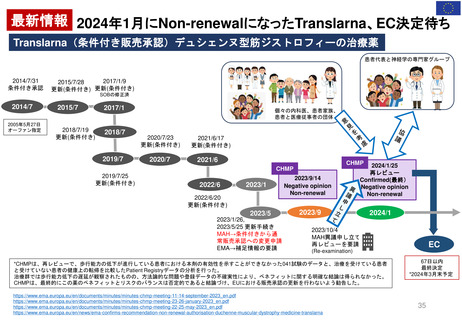
2.日本の再審査制度に相当するEMAの製造販売承認の更新制度
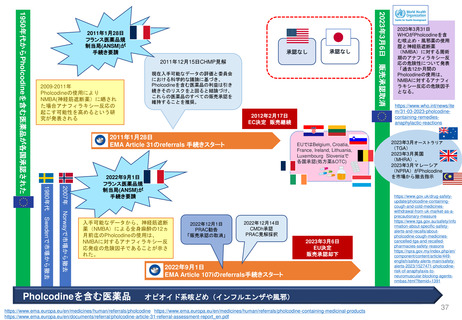
3.日本の再評価制度に相当するEMAの制度の有無
4.日本の再審査制度に相当する FDAの制度の有無
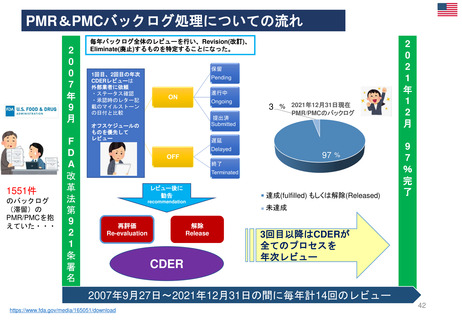
⚫FDA改革法とPMRのバックログ(滞留・未処理分)
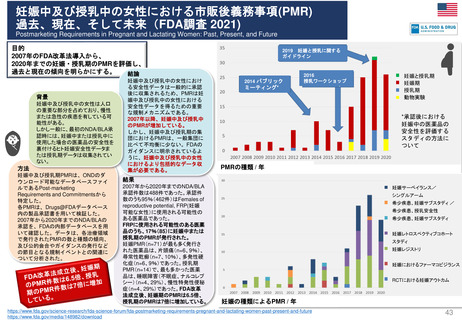
⚫妊娠中及び授乳中の女性における市販後義務事項(PMR)
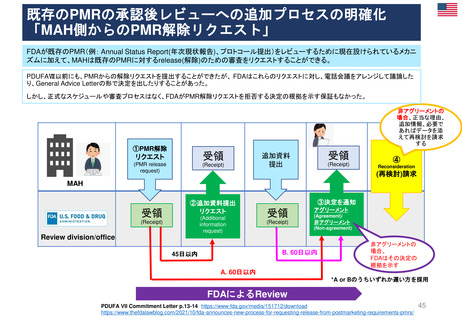
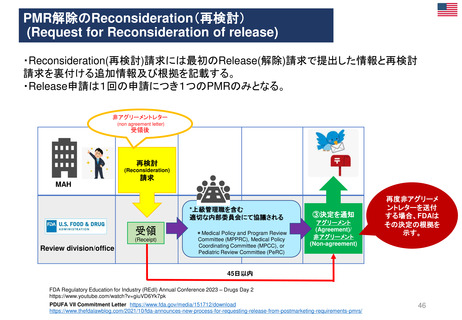
⚫PDUFAⅦ(2023-2027)におけるPMRの新しい手続き
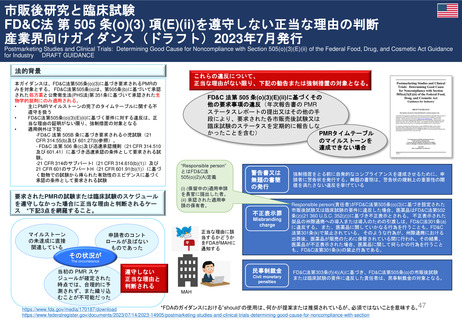
⚫市販後研究と臨床試験 FD&C法 第 505 条(o)(3) 項(E)(ii)を
遵守しない正当な理由の判断
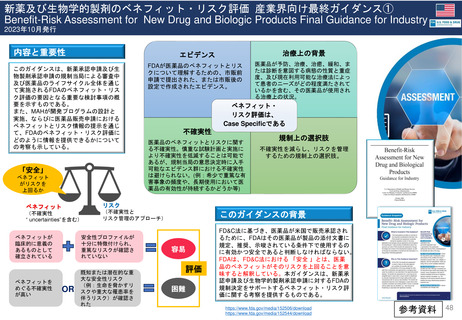
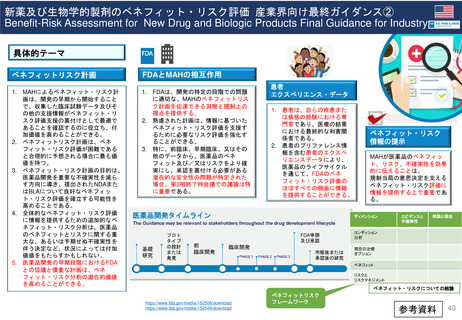
⚫新薬及び生物学的製剤のベネフィット・リスク評価
産業界向け最終ガイダンス 参考資料
40
2.日本の再審査制度に相当するEMAの製造販売承認の更新制度
3.日本の再評価制度に相当するEMAの制度の有無
4.日本の再審査制度に相当する FDAの制度の有無
⚫FDA改革法とPMRのバックログ(滞留・未処理分)
⚫妊娠中及び授乳中の女性における市販後義務事項(PMR)
⚫PDUFAⅦ(2023-2027)におけるPMRの新しい手続き
⚫市販後研究と臨床試験 FD&C法 第 505 条(o)(3) 項(E)(ii)を
遵守しない正当な理由の判断
⚫新薬及び生物学的製剤のベネフィット・リスク評価
産業界向け最終ガイダンス 参考資料
40