よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
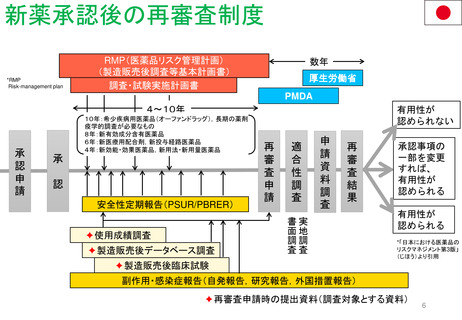
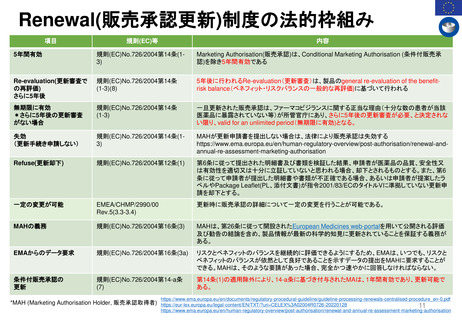
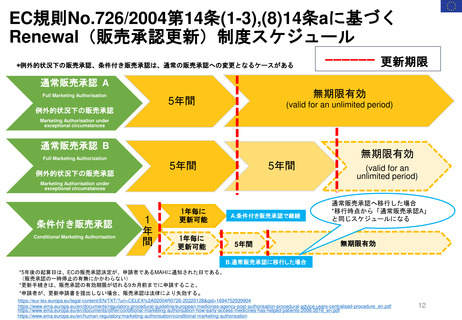
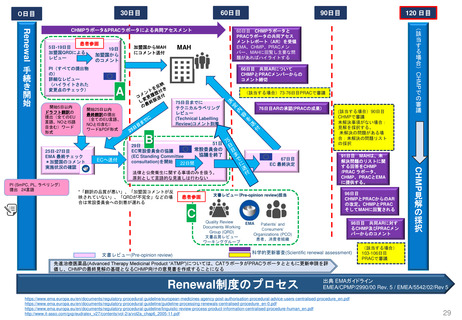
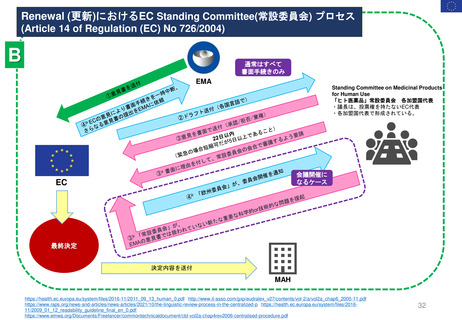
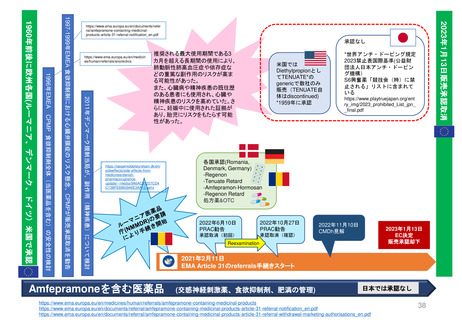
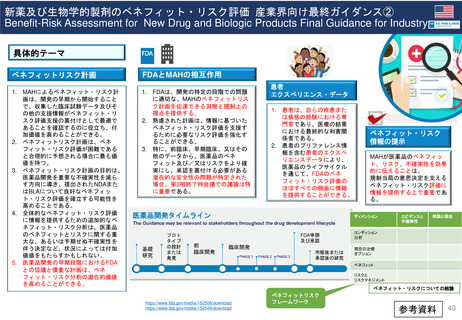
EC規則No.726/2004第14条(1-3),(8)14条aに基づく
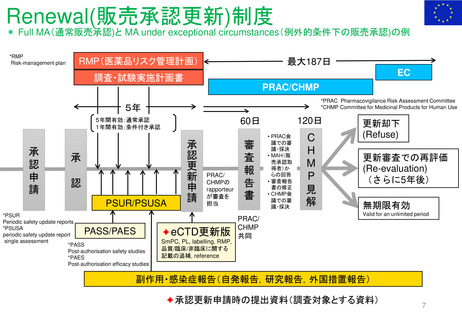
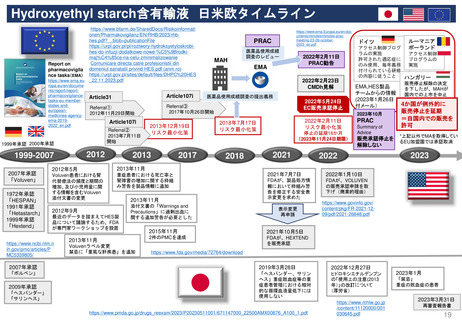
Renewal(販売承認更新)制度スケジュール
------ 更新期限
*例外的状況下の販売承認、条件付き販売承認は、通常の販売承認への変更となるケースがある
通常販売承認 A
Full Marketing Authorisation
無期限有効
5年間
(valid for an unlimited period)
例外的状況下の販売承認
Marketing Authorisation under
exceptional circumstances
通常販売承認 B
無期限有効
Full Marketing Authorization
5年間
例外的状況下の販売承認
5年間
(valid for an
unlimited period)
Marketing Authorisation under
exceptional circumstances
条件付き販売承認
Conditional Marketing Authorisation
1
年
間
1年毎に
更新可能
A.条件付き販売承認で継続
1年毎に
更新可能
5年間
通常販売承認へ移行した場合
*移行時点から「通常販売承認A」
と同じスケジュールになる
無期限有効
B.通常販売承認に移行した場合
*5年後の起算日は、ECの販売承認決定が、申請者であるMAHに通知された日である。
(販売承認の一時停止の有無にかかわらない)
*更新手続きは、販売承認の有効期限が切れる9カ月前までに申請すること。
*申請者が、更新申請書を提出しない場合、販売承認は法律により失効する。
https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX%3A02004R0726-20220128&qid=1694752939904
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/european-medicines-agency-post-authorisation-procedural-advice-users-centralised-procedure_en.pdf
https://www.ema.europa.eu/en/documents/other/conditional-marketing-authorisation-how-early-access-medicines-has-helped-patients-2006-2016_en.pdf
https://www.ema.europa.eu/en/human-regulatory/marketing-authorisation/conditional-marketing-authorisation
12
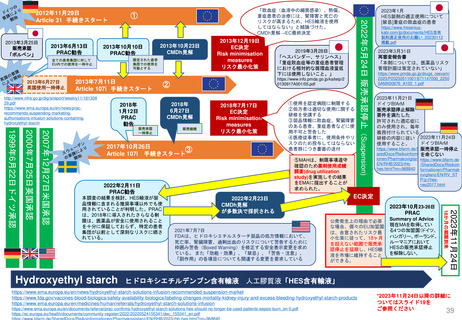
Renewal(販売承認更新)制度スケジュール
------ 更新期限
*例外的状況下の販売承認、条件付き販売承認は、通常の販売承認への変更となるケースがある
通常販売承認 A
Full Marketing Authorisation
無期限有効
5年間
(valid for an unlimited period)
例外的状況下の販売承認
Marketing Authorisation under
exceptional circumstances
通常販売承認 B
無期限有効
Full Marketing Authorization
5年間
例外的状況下の販売承認
5年間
(valid for an
unlimited period)
Marketing Authorisation under
exceptional circumstances
条件付き販売承認
Conditional Marketing Authorisation
1
年
間
1年毎に
更新可能
A.条件付き販売承認で継続
1年毎に
更新可能
5年間
通常販売承認へ移行した場合
*移行時点から「通常販売承認A」
と同じスケジュールになる
無期限有効
B.通常販売承認に移行した場合
*5年後の起算日は、ECの販売承認決定が、申請者であるMAHに通知された日である。
(販売承認の一時停止の有無にかかわらない)
*更新手続きは、販売承認の有効期限が切れる9カ月前までに申請すること。
*申請者が、更新申請書を提出しない場合、販売承認は法律により失効する。
https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX%3A02004R0726-20220128&qid=1694752939904
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/european-medicines-agency-post-authorisation-procedural-advice-users-centralised-procedure_en.pdf
https://www.ema.europa.eu/en/documents/other/conditional-marketing-authorisation-how-early-access-medicines-has-helped-patients-2006-2016_en.pdf
https://www.ema.europa.eu/en/human-regulatory/marketing-authorisation/conditional-marketing-authorisation
12