よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
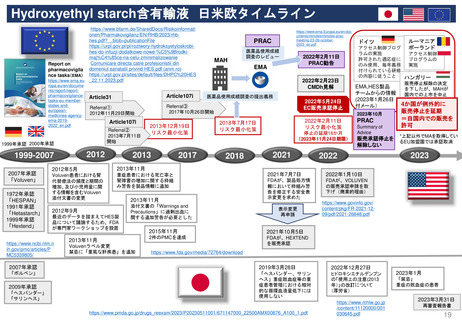
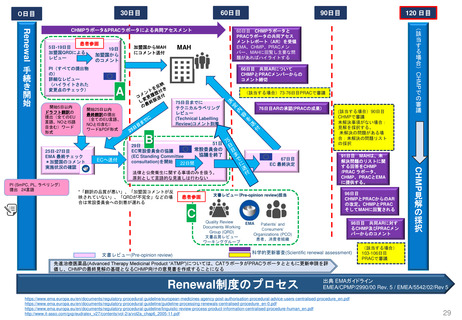
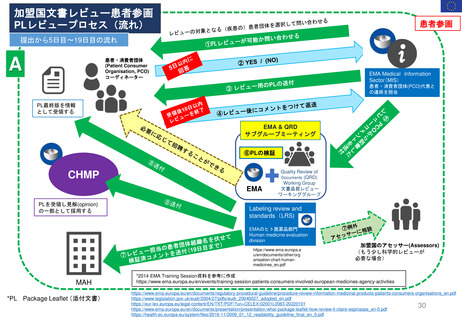
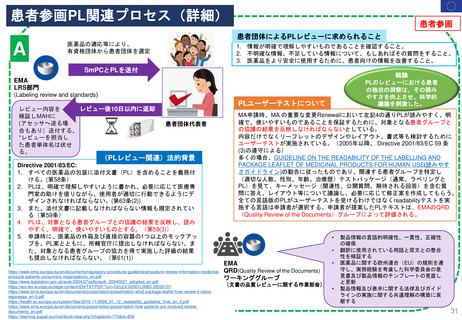
3. 日本の再審査制度に相当する
FDAの制度の有無
• FDAのサイトでは、日本の新薬承認後の
再審査制度や、EUの販売承認更新制度に
相当するような制度を説明するページは
確認できなかった
日本の再審査に
相当する制度は
米国にはない
と考えられる
• 部分的でも主旨/目的を同じくする取組み
• 日本の制度において提出が必要となる個々の資料について、
米国でどのように評価等がなされているか
について調査した。
21
FDAの制度の有無
• FDAのサイトでは、日本の新薬承認後の
再審査制度や、EUの販売承認更新制度に
相当するような制度を説明するページは
確認できなかった
日本の再審査に
相当する制度は
米国にはない
と考えられる
• 部分的でも主旨/目的を同じくする取組み
• 日本の制度において提出が必要となる個々の資料について、
米国でどのように評価等がなされているか
について調査した。
21