よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
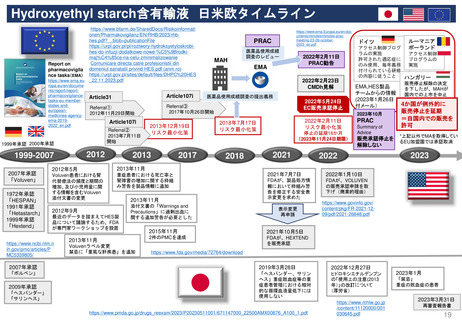
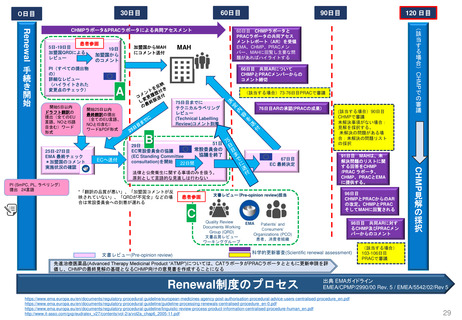
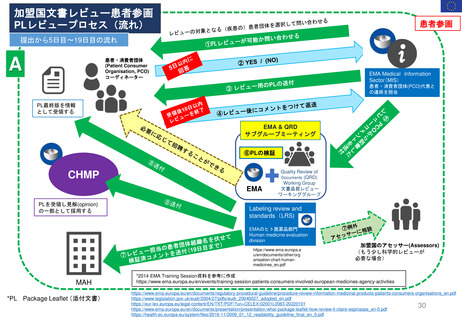
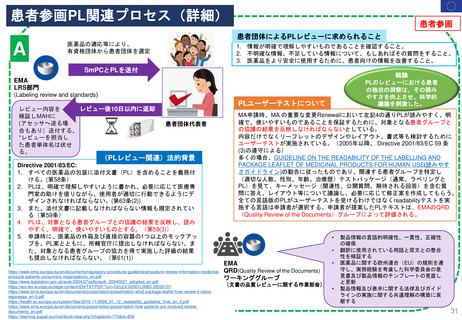
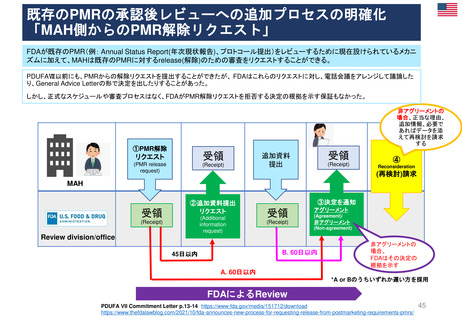
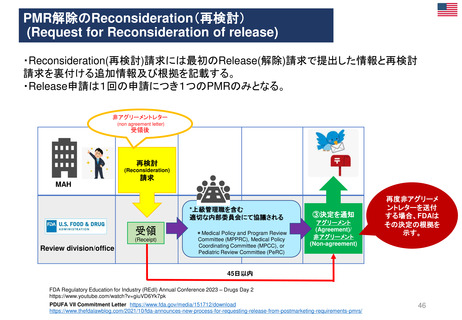
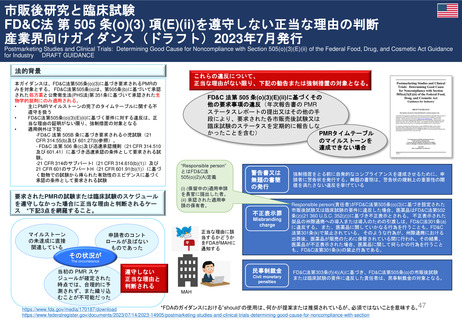
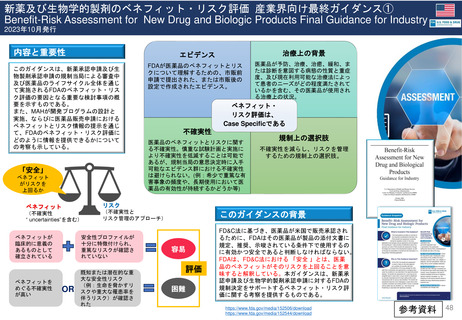
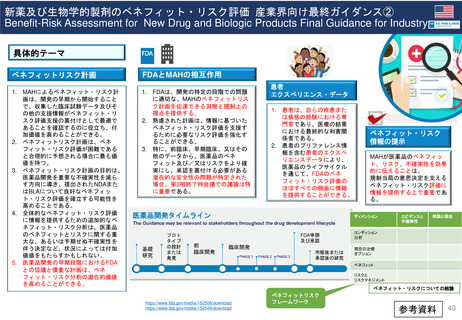
FDAの承認後医薬品の安全性評価体制
• CDERのサイトの他、市販後規制要件(市販後安全性報告、承認後のその他
の報告事項等)及び承認取得後に行う活動(承認事項一部変更、PMR/PMC、
REMS、添付文書改訂等)に関するMAH(製造販売取得者)向けのビデオ教材
及び業界向けガイダンスを参考にした。
• 連邦規則21章(21 CFR)のヒト用医薬品に関する条項(Parts 300-499)
の中から関連する記載事項を調査した。
• FDA以外の団体(PhRMA、DIA 等)の公開情報から情報を得た。
• 個別医薬品の安全性問題に関する情報(FDAが講じた措置等)から遡って
承認薬の再審査・再評価に相当する評価がどのように行われたか(特
に承認取り消しとなった医薬品等について)調査した。
*CDER Center for Drug Evaluation and Research (FDA)
*PhRMA Pharmaceutical Research and Manufacturers of America
*DIA Drug Information Association
22
• CDERのサイトの他、市販後規制要件(市販後安全性報告、承認後のその他
の報告事項等)及び承認取得後に行う活動(承認事項一部変更、PMR/PMC、
REMS、添付文書改訂等)に関するMAH(製造販売取得者)向けのビデオ教材
及び業界向けガイダンスを参考にした。
• 連邦規則21章(21 CFR)のヒト用医薬品に関する条項(Parts 300-499)
の中から関連する記載事項を調査した。
• FDA以外の団体(PhRMA、DIA 等)の公開情報から情報を得た。
• 個別医薬品の安全性問題に関する情報(FDAが講じた措置等)から遡って
承認薬の再審査・再評価に相当する評価がどのように行われたか(特
に承認取り消しとなった医薬品等について)調査した。
*CDER Center for Drug Evaluation and Research (FDA)
*PhRMA Pharmaceutical Research and Manufacturers of America
*DIA Drug Information Association
22