よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (48 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
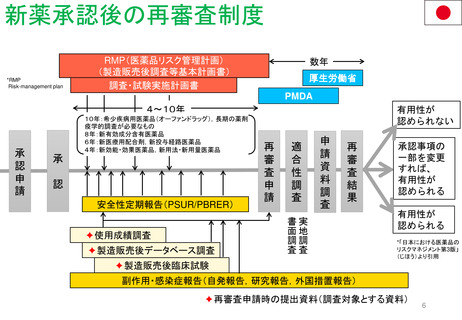
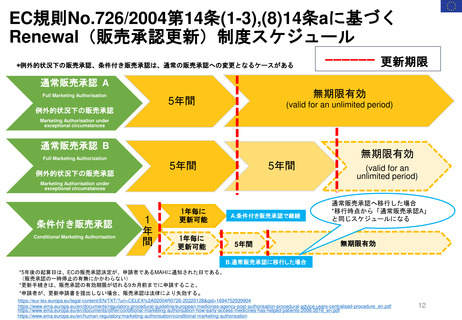
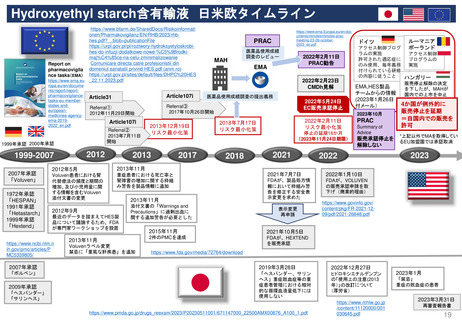
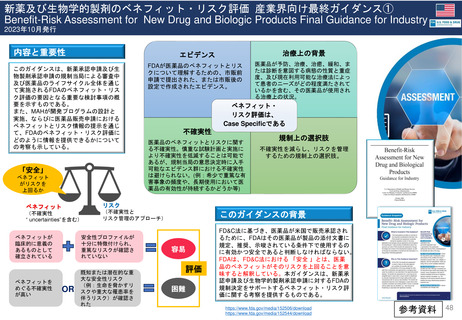
新薬及び生物学的製剤のベネフィット・リスク評価 産業界向け最終ガイダンス①
Benefit-Risk Assessment for New Drug and Biologic Products Final Guidance for Industry
2023年10月発行
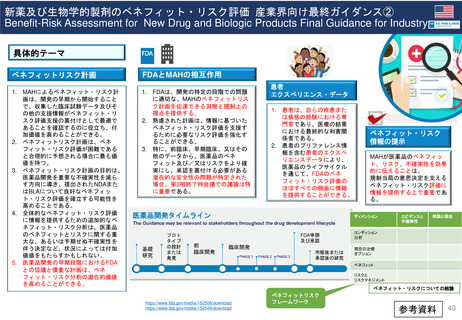
内容と重要性
このガイダンスは、新薬承認申請及び生
物製剤承認申請の規制当局による審査中
及び医薬品のライフサイクル全体を通じ
て実施されるFDAのベネフィット・リス
ク評価の要因となる重要な検討事項の概
要を示すものである。
また、MAHが開発プログラムの設計と
実施、ならびに医薬品販売申請における
ベネフィットとリスク情報の提示を通じ
て、FDAのベネフィット・リスク評価に
どのように情報を提供できるかについて
の考察も示している。
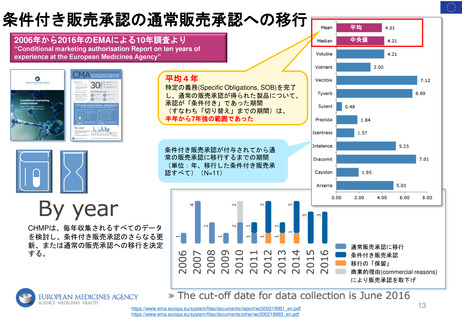
「安全」
ベネフィット
がリスクを
上回るか
エビデンス
治療上の背景
FDAが医薬品のベネフィットとリス
クについて理解するための、市販前
申請で提出された、または市販後の
設定で作成されたエビデンス。
医薬品が予防、治療、治癒、緩和、ま
たは診断を意図する病態の性質と重症
度、及び現在利用可能な治療法によっ
て患者のニーズがどの程度満たされて
いるかを含む、その医薬品が使用され
る治療上の状況。
ベネフィット・
リスク評価は、
Case Specificである
不確実性
医薬品のベネフィットとリスクに関す
る不確実性。慎重な試験計画と実施に
より不確実性を低減することは可能で
あるが、規制当局の意思決定時に入手
可能なエビデンス群における不確実性
は避けられない。(例:希少で重篤な有
害事象の頻度や、長期使用において医
薬品の有効性が持続するかどうか等)
規制上の選択肢
不確実性を減らし、リスクを管理
するための規制上の選択肢。
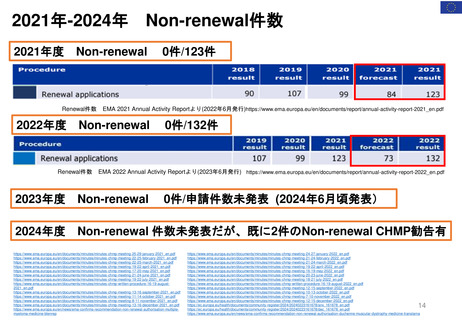
リスク
ベネフィット
(不確実性
“ uncertainties”を含む)
(不確実性と
リスク管理のアプローチ)
ベネフィットが
臨床的に意義の
あるものとして
確立されている
安全性プロファイルが
十分に特徴付けられ、
重篤なリスクが確認さ
れていない
ベネフィットを
めぐる不確実性
が高い
既知または潜在的な重
大な安全性リスク
(例:生命を脅かすリ
スクや重大な罹患率を
伴うリスク)が確認さ
れた
OR
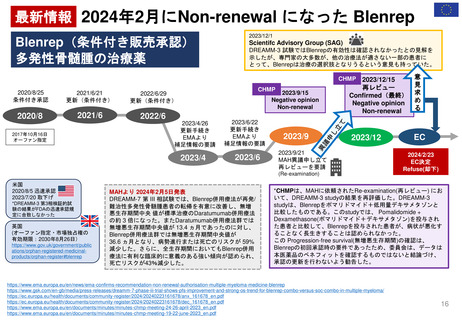
このガイダンスの背景
容易
評価
困難
FD&C法に基づき、医薬品が米国で販売承認され
るために、FDAはその医薬品が製品の添付文書に
規定、推奨、示唆されている条件下で使用するの
に有効かつ安全であると判断しなければならない。
FDAは、FD&C法における 「安全 」とは、医薬
品のベネフィットがそのリスクを上回ることを意
味すると解釈している。本ガイダンスは、新薬承
認申請及び生物学的製剤承認申請に対するFDAの
規制決定をサポートするベネフィット・リスク評
価に関する考察を提供するものである。
https://www.fda.gov/media/152506/download
https://www.fda.gov/media/152544/download
参考資料
48
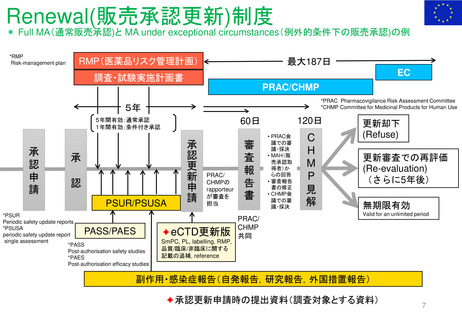
Benefit-Risk Assessment for New Drug and Biologic Products Final Guidance for Industry
2023年10月発行
内容と重要性
このガイダンスは、新薬承認申請及び生
物製剤承認申請の規制当局による審査中
及び医薬品のライフサイクル全体を通じ
て実施されるFDAのベネフィット・リス
ク評価の要因となる重要な検討事項の概
要を示すものである。
また、MAHが開発プログラムの設計と
実施、ならびに医薬品販売申請における
ベネフィットとリスク情報の提示を通じ
て、FDAのベネフィット・リスク評価に
どのように情報を提供できるかについて
の考察も示している。
「安全」
ベネフィット
がリスクを
上回るか
エビデンス
治療上の背景
FDAが医薬品のベネフィットとリス
クについて理解するための、市販前
申請で提出された、または市販後の
設定で作成されたエビデンス。
医薬品が予防、治療、治癒、緩和、ま
たは診断を意図する病態の性質と重症
度、及び現在利用可能な治療法によっ
て患者のニーズがどの程度満たされて
いるかを含む、その医薬品が使用され
る治療上の状況。
ベネフィット・
リスク評価は、
Case Specificである
不確実性
医薬品のベネフィットとリスクに関す
る不確実性。慎重な試験計画と実施に
より不確実性を低減することは可能で
あるが、規制当局の意思決定時に入手
可能なエビデンス群における不確実性
は避けられない。(例:希少で重篤な有
害事象の頻度や、長期使用において医
薬品の有効性が持続するかどうか等)
規制上の選択肢
不確実性を減らし、リスクを管理
するための規制上の選択肢。
リスク
ベネフィット
(不確実性
“ uncertainties”を含む)
(不確実性と
リスク管理のアプローチ)
ベネフィットが
臨床的に意義の
あるものとして
確立されている
安全性プロファイルが
十分に特徴付けられ、
重篤なリスクが確認さ
れていない
ベネフィットを
めぐる不確実性
が高い
既知または潜在的な重
大な安全性リスク
(例:生命を脅かすリ
スクや重大な罹患率を
伴うリスク)が確認さ
れた
OR
このガイダンスの背景
容易
評価
困難
FD&C法に基づき、医薬品が米国で販売承認され
るために、FDAはその医薬品が製品の添付文書に
規定、推奨、示唆されている条件下で使用するの
に有効かつ安全であると判断しなければならない。
FDAは、FD&C法における 「安全 」とは、医薬
品のベネフィットがそのリスクを上回ることを意
味すると解釈している。本ガイダンスは、新薬承
認申請及び生物学的製剤承認申請に対するFDAの
規制決定をサポートするベネフィット・リスク評
価に関する考察を提供するものである。
https://www.fda.gov/media/152506/download
https://www.fda.gov/media/152544/download
参考資料
48