よむ、つかう、まなぶ。
【資料3】令和5年度欧米の市販後安全対策を中心とした薬事制度に関する調査[3.1MB] (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38915.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第15回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
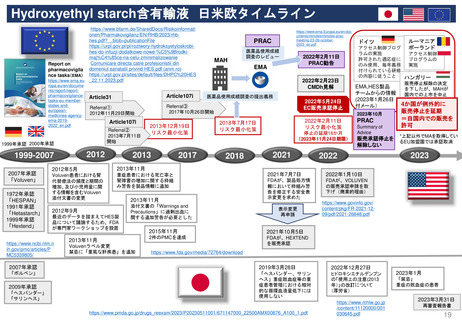
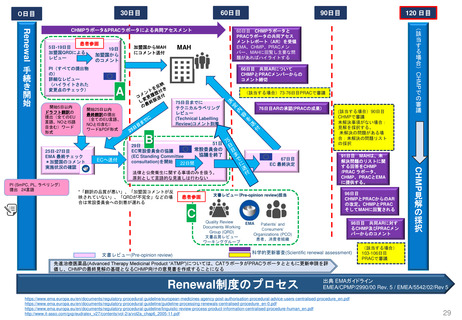
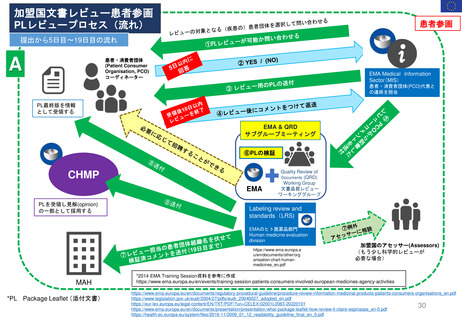
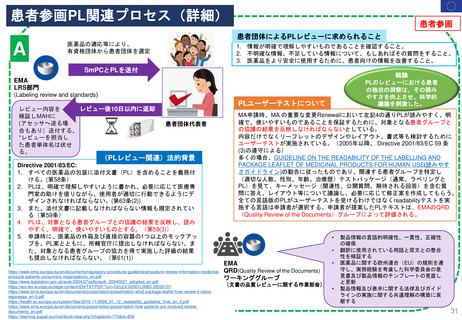
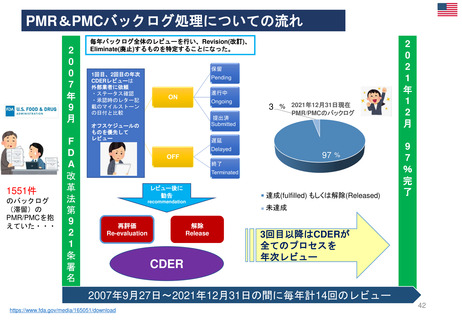
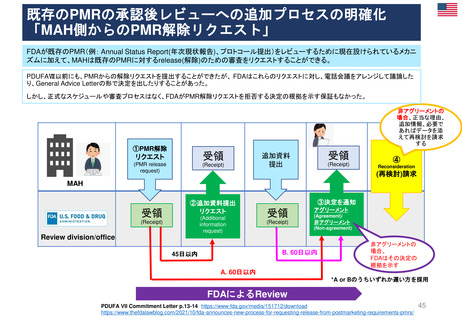
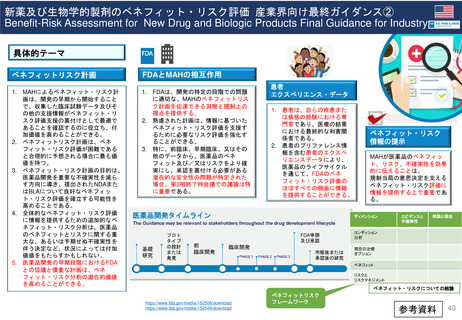
米国の医薬品安全性監視(ファーマコビジランス)システム
Postmarket Drug and Biologic Safety Evaluations
(市販後医薬品安全性評価)
◆ 日本の使用成績調査と目的は同じであるが、
調査・評価はFDA主体で行われた
• FDA改革法により、2007年9月27日以降にNDA(New Drug
Applications:新薬承認申請)及びBLA(Biologic License
Applications:生物製剤承認申請)の承認を受けた医薬品が対象
• 製品が承認後に広く一般に使用された後
‒ 開発段階では特定されなかった新たな重篤な有害事象
‒ 既知であるが通常より報告数が多い副作用
‒ 新たな安全性の懸念
が生じていないか明らかにする。
• 医薬品の承認後18カ月、または使用者が1万人に達した時点の
いずれか遅い方で実施
• 2017年9月までで終了。理由は、他の監視活動と重複する、リソースが有効に活
用されていない、希少疾患用医薬品の多くは評価開始の基準である使用者1万人と
いう条件を満たせず柔軟性に欠ける、等 <FDAAA(FDA改革法) 2007 Section 915>
https://www.fda.gov/drugs/surveillance/postmarket-drug-and-biologic-safety-evaluations
23
Postmarket Drug and Biologic Safety Evaluations
(市販後医薬品安全性評価)
◆ 日本の使用成績調査と目的は同じであるが、
調査・評価はFDA主体で行われた
• FDA改革法により、2007年9月27日以降にNDA(New Drug
Applications:新薬承認申請)及びBLA(Biologic License
Applications:生物製剤承認申請)の承認を受けた医薬品が対象
• 製品が承認後に広く一般に使用された後
‒ 開発段階では特定されなかった新たな重篤な有害事象
‒ 既知であるが通常より報告数が多い副作用
‒ 新たな安全性の懸念
が生じていないか明らかにする。
• 医薬品の承認後18カ月、または使用者が1万人に達した時点の
いずれか遅い方で実施
• 2017年9月までで終了。理由は、他の監視活動と重複する、リソースが有効に活
用されていない、希少疾患用医薬品の多くは評価開始の基準である使用者1万人と
いう条件を満たせず柔軟性に欠ける、等 <FDAAA(FDA改革法) 2007 Section 915>
https://www.fda.gov/drugs/surveillance/postmarket-drug-and-biologic-safety-evaluations
23