よむ、つかう、まなぶ。
総-3薬価基準見直し案 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_68748.html |
| 出典情報 | 中央社会保険医療協議会 総会(第642回 1/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
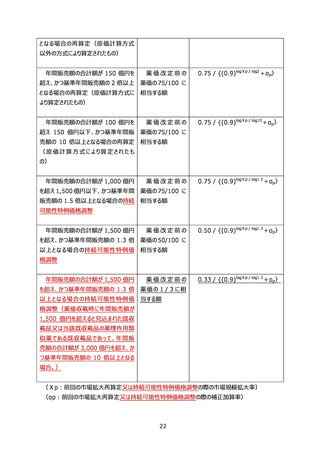
① 新医療用配合剤に係る全ての単剤等について、製造販売業者が当該新医療用配合剤
と同一のものがある場合(④の場合を除く。)
イ 算定の特例
第1部及び前部の規定に関わらず、新医療用配合剤に係る全ての単剤等(製造販売
業者が当該新医療用配合剤と同一のものを用いるものとする。)の組合せを比較薬として、
類似薬効比較方式(Ⅰ)によって算定される額に 100 分の 80 を乗じて得た額(補正加
算の対象となる場合(市場性加算(Ⅰ)については、当該新規収載品の比較薬が市場
性加算(Ⅰ)の適用を受けていない場合に限り、市場性加算(Ⅱ)については、当該新
規収載品の比較薬が市場性加算(Ⅰ)又は市場性加算(Ⅱ)の適用を受けていない
場合に限り、特定用途加算については、当該新規収載品の比較薬が特定用途加算の適
用を受けていない場合に限り、小児加算については、当該新規収載品の比較薬が特定用
途加算(小児の疾病の治療等に係る指定を受けた特定用途医薬品について当該加算の
対象となった場合に限る。)又は小児加算の適用を受けていない場合(ただし、「成人を対
象とした医薬品の開発期間中に行う小児用医薬品の開発計画の策定について」(令和6
年1月 12 日付け医薬薬審発 0112 第3号厚生労働省医薬局医薬品審査管理課長
通知)に基づき独立行政法人医薬品医療機器総合機構の確認を受けた小児用医薬品
の開発計画に基づき遅滞なく開発が進められ、承認を受けた品目については、この限りでな
い。)に限る。以下この項において同じ。)には当該額に補正加算を行った額)を当該新
医療用配合剤の薬価とする。
ロ、ハ(略)
②~⑤(略)
6、7(略)
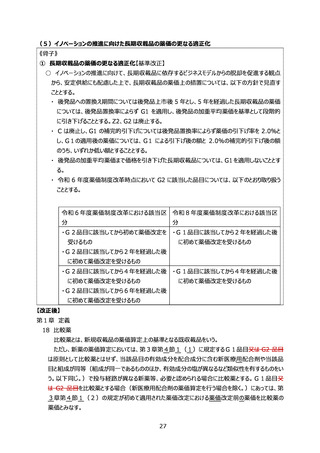
8 ラセミ体又は先行品が存在する新薬の薬価算定
(1)(略)
(2)ラセミ体又は先行品が存在する新薬の特例
イ 算定の特例
第1部の規定に関わらず、当該ラセミ体の既収載品又は当該先行品を比較薬とした類
似薬効比較方式(Ⅰ)によって算定される額に 100 分の 80 を乗じて得た額(補正加算
の対象となる場合(市場性加算(Ⅰ)については、当該新規収載品の比較薬が市場性
加算(Ⅰ)の適用を受けていない場合に限り、市場性加算(Ⅱ)については、当該新規
収載品の比較薬が市場性加算(Ⅰ)又は市場性加算(Ⅱ)の適用を受けていない場
合に限り、特定用途加算については、当該新規収載品の比較薬が特定用途加算の適用を
受けていない場合に限り、小児加算については、当該新規収載品の比較薬が特定用途加
算(小児の疾病の治療等に係る指定を受けた特定用途医薬品について当該加算の対象
4
と同一のものがある場合(④の場合を除く。)
イ 算定の特例
第1部及び前部の規定に関わらず、新医療用配合剤に係る全ての単剤等(製造販売
業者が当該新医療用配合剤と同一のものを用いるものとする。)の組合せを比較薬として、
類似薬効比較方式(Ⅰ)によって算定される額に 100 分の 80 を乗じて得た額(補正加
算の対象となる場合(市場性加算(Ⅰ)については、当該新規収載品の比較薬が市場
性加算(Ⅰ)の適用を受けていない場合に限り、市場性加算(Ⅱ)については、当該新
規収載品の比較薬が市場性加算(Ⅰ)又は市場性加算(Ⅱ)の適用を受けていない
場合に限り、特定用途加算については、当該新規収載品の比較薬が特定用途加算の適
用を受けていない場合に限り、小児加算については、当該新規収載品の比較薬が特定用
途加算(小児の疾病の治療等に係る指定を受けた特定用途医薬品について当該加算の
対象となった場合に限る。)又は小児加算の適用を受けていない場合(ただし、「成人を対
象とした医薬品の開発期間中に行う小児用医薬品の開発計画の策定について」(令和6
年1月 12 日付け医薬薬審発 0112 第3号厚生労働省医薬局医薬品審査管理課長
通知)に基づき独立行政法人医薬品医療機器総合機構の確認を受けた小児用医薬品
の開発計画に基づき遅滞なく開発が進められ、承認を受けた品目については、この限りでな
い。)に限る。以下この項において同じ。)には当該額に補正加算を行った額)を当該新
医療用配合剤の薬価とする。
ロ、ハ(略)
②~⑤(略)
6、7(略)
8 ラセミ体又は先行品が存在する新薬の薬価算定
(1)(略)
(2)ラセミ体又は先行品が存在する新薬の特例
イ 算定の特例
第1部の規定に関わらず、当該ラセミ体の既収載品又は当該先行品を比較薬とした類
似薬効比較方式(Ⅰ)によって算定される額に 100 分の 80 を乗じて得た額(補正加算
の対象となる場合(市場性加算(Ⅰ)については、当該新規収載品の比較薬が市場性
加算(Ⅰ)の適用を受けていない場合に限り、市場性加算(Ⅱ)については、当該新規
収載品の比較薬が市場性加算(Ⅰ)又は市場性加算(Ⅱ)の適用を受けていない場
合に限り、特定用途加算については、当該新規収載品の比較薬が特定用途加算の適用を
受けていない場合に限り、小児加算については、当該新規収載品の比較薬が特定用途加
算(小児の疾病の治療等に係る指定を受けた特定用途医薬品について当該加算の対象
4