よむ、つかう、まなぶ。
参考資料2 (12 ページ)
出典
| 公開元URL | https://www.mof.go.jp/about_mof/councils/fiscal_system_council/sub-of_fiscal_system/report/zaiseia20220525/zaiseia20220525.html |
| 出典情報 | 財政制度等審議会 歴史の転換点における財政運営(5/25)《財務省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
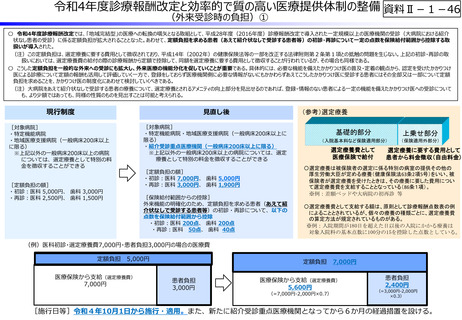
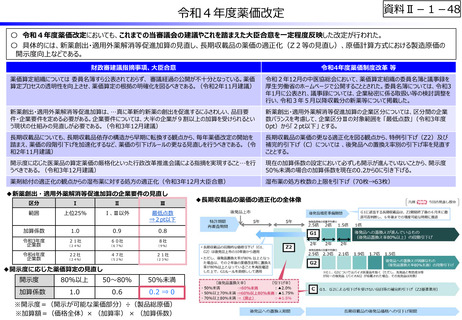
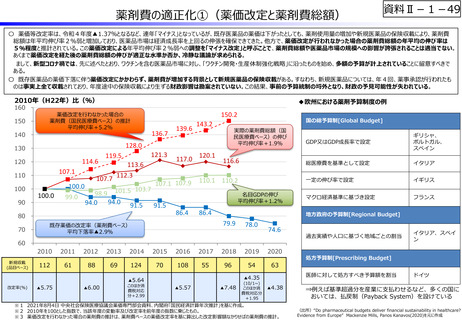
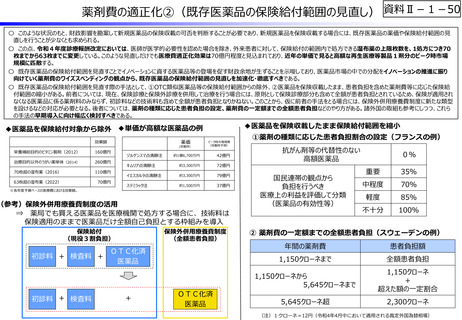
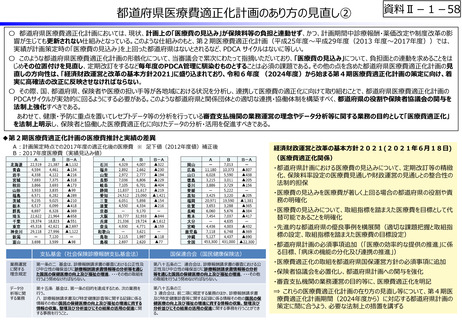
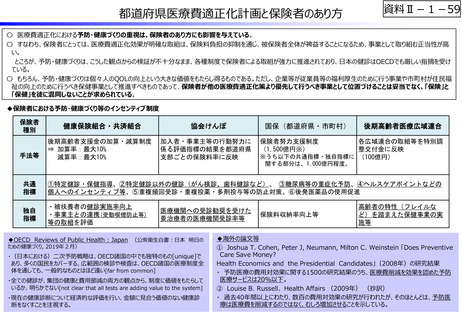
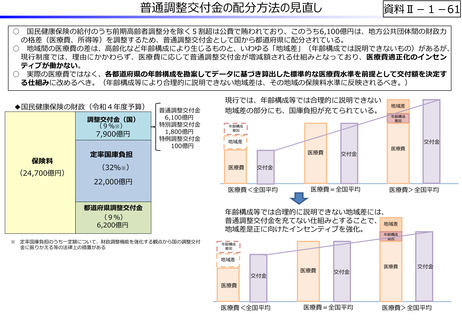
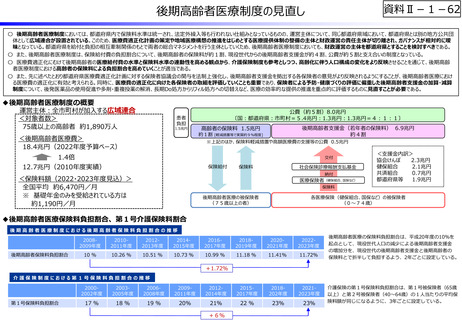
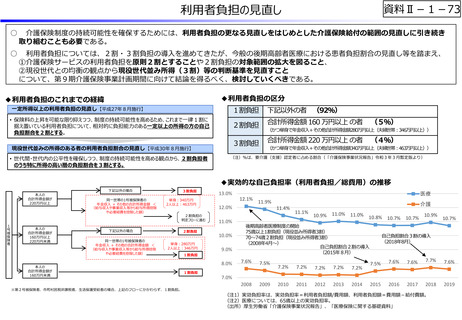
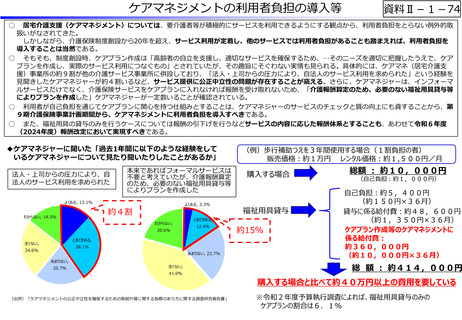
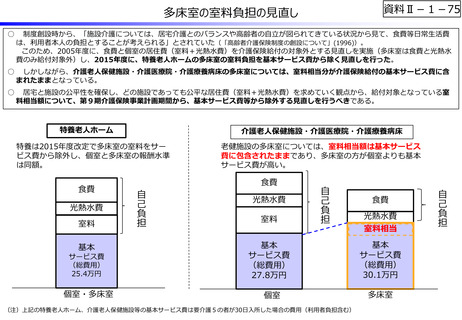
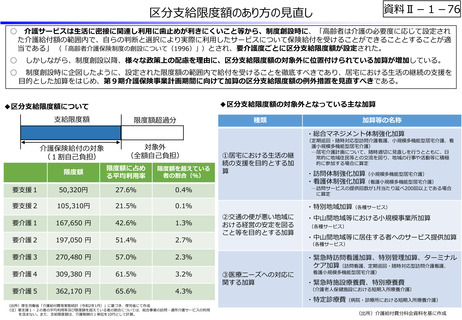
資料Ⅱ-1-12
治療薬
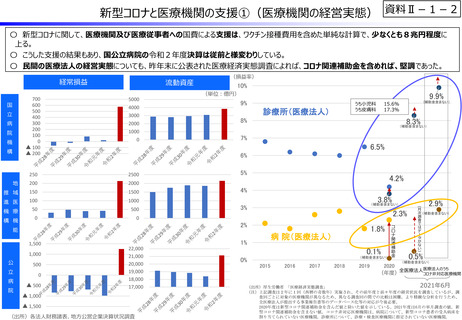
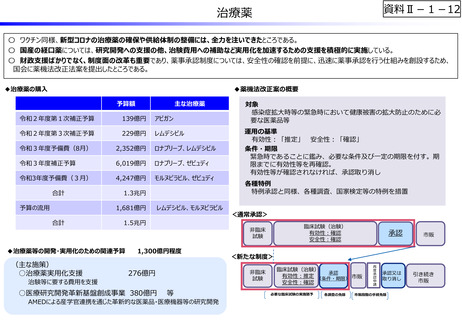
〇 ワクチン同様、新型コロナの治療薬の確保や供給体制の整備には、全力を注いできたところである。
〇 国産の経口薬については、研究開発への支援の他、治験費用への補助など実用化を加速するための支援を積極的に実施している。
〇 財政支援ばかりでなく、制度面の改革も重要であり、薬事承認制度については、安全性の確認を前提に、迅速に薬事承認を行う仕組みを創設するため、
国会に薬機法改正法案を提出したところである。
◆薬機法改正案の概要
◆治療薬の購入
予算額
主な治療薬
令和2年度第1次補正予算
139億円
アビガン
令和2年度第3次補正予算
229億円
レムデシビル
令和3年度予備費(8月)
2,352億円
ロナプリーブ、レムデシビル
令和3年度補正予算
6,019億円
ロナプリーブ、ゼビュディ
令和3年度予備費(3月)
4,247億円
モルヌピラビル、ゼビュディ
合計
予算の流用
1.3兆円
1,681億円
合計
1.5兆円
◆治療薬等の開発・実用化のための関連予算
治験等に要する費用を支援
各種特例
特例承認と同様、各種調査、国家検定等の特例を措置
<通常承認>
臨床試験(治験)
有効性:確認
安全性:確認
非臨床
試験
1,300億円程度
276億円
○医療研究開発革新基盤創成事業 380億円
運用の基準
有効性:「推定」 安全性:「確認」
条件・期限
緊急時であることに鑑み、必要な条件及び一定の期限を付す。期
限までに有効性等を再確認。
有効性等が確認されなければ、承認取り消し
<新たな制度>
非臨床
試験
等
AMEDによる産学官連携を通じた革新的な医薬品・医療機器等の研究開発
臨床試験(治験)
承認
有効性:推定 (条件・期限) 市販
安全性:確認
必要な臨床試験の実施猶予
各調査の免除
再度承認申請
(主な施策)
○治療薬実用化支援
レムデシビル、モルヌピラビル
対象
感染症拡大時等の緊急時において健康被害の拡大防止のために必
要な医薬品等
承認
市販
承認又は
取り消し
引き続き
市販
市販段階の手続免除
治療薬
〇 ワクチン同様、新型コロナの治療薬の確保や供給体制の整備には、全力を注いできたところである。
〇 国産の経口薬については、研究開発への支援の他、治験費用への補助など実用化を加速するための支援を積極的に実施している。
〇 財政支援ばかりでなく、制度面の改革も重要であり、薬事承認制度については、安全性の確認を前提に、迅速に薬事承認を行う仕組みを創設するため、
国会に薬機法改正法案を提出したところである。
◆薬機法改正案の概要
◆治療薬の購入
予算額
主な治療薬
令和2年度第1次補正予算
139億円
アビガン
令和2年度第3次補正予算
229億円
レムデシビル
令和3年度予備費(8月)
2,352億円
ロナプリーブ、レムデシビル
令和3年度補正予算
6,019億円
ロナプリーブ、ゼビュディ
令和3年度予備費(3月)
4,247億円
モルヌピラビル、ゼビュディ
合計
予算の流用
1.3兆円
1,681億円
合計
1.5兆円
◆治療薬等の開発・実用化のための関連予算
治験等に要する費用を支援
各種特例
特例承認と同様、各種調査、国家検定等の特例を措置
<通常承認>
臨床試験(治験)
有効性:確認
安全性:確認
非臨床
試験
1,300億円程度
276億円
○医療研究開発革新基盤創成事業 380億円
運用の基準
有効性:「推定」 安全性:「確認」
条件・期限
緊急時であることに鑑み、必要な条件及び一定の期限を付す。期
限までに有効性等を再確認。
有効性等が確認されなければ、承認取り消し
<新たな制度>
非臨床
試験
等
AMEDによる産学官連携を通じた革新的な医薬品・医療機器等の研究開発
臨床試験(治験)
承認
有効性:推定 (条件・期限) 市販
安全性:確認
必要な臨床試験の実施猶予
各調査の免除
再度承認申請
(主な施策)
○治療薬実用化支援
レムデシビル、モルヌピラビル
対象
感染症拡大時等の緊急時において健康被害の拡大防止のために必
要な医薬品等
承認
市販
承認又は
取り消し
引き続き
市販
市販段階の手続免除