よむ、つかう、まなぶ。
○個別事項(その9)について-3 (71 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00127.html |
| 出典情報 | 中央社会保険医療協議会 総会(第504回 12/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
バイオ後続品について
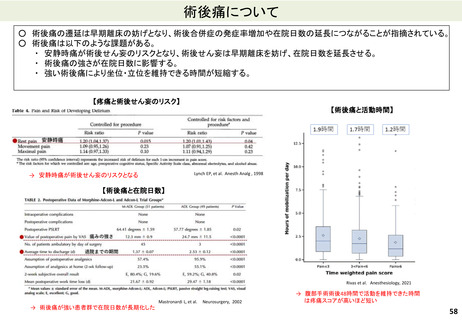
バイオ後続品の定義
○ バイオ後続品とは、国内で既に新有効成分含有医薬品として承認されたバイオテクノロ
ジー応用医薬品(以下「先行バイオ医薬品」という。)と同等/同質の品質、安全性、有
効性を有する医薬品として、異なる製造販売業者により開発される医薬品である。
先行バイオ医薬品との同等性/同質性とは
○ 「同等性/同質性」とは、先行バイオ医薬品とバイオ後続品の品質特性の類似性が高く、
品質特性に何らかの差異が見出されたとしても、製造販売する製品の臨床的有効性・
安全性に影響を及ぼすものではないことが、非臨床試験及び臨床試験等の結果に基づ
いて科学的に判断できることを意味する。
厚生労働省医薬・生活衛生局医薬品審査管理課長通知「バイオ後続品の品質・安全性・有効性確保のための指針」について(薬生薬審発0204 第1号、令和2年2月4日)71
バイオ後続品の定義
○ バイオ後続品とは、国内で既に新有効成分含有医薬品として承認されたバイオテクノロ
ジー応用医薬品(以下「先行バイオ医薬品」という。)と同等/同質の品質、安全性、有
効性を有する医薬品として、異なる製造販売業者により開発される医薬品である。
先行バイオ医薬品との同等性/同質性とは
○ 「同等性/同質性」とは、先行バイオ医薬品とバイオ後続品の品質特性の類似性が高く、
品質特性に何らかの差異が見出されたとしても、製造販売する製品の臨床的有効性・
安全性に影響を及ぼすものではないことが、非臨床試験及び臨床試験等の結果に基づ
いて科学的に判断できることを意味する。
厚生労働省医薬・生活衛生局医薬品審査管理課長通知「バイオ後続品の品質・安全性・有効性確保のための指針」について(薬生薬審発0204 第1号、令和2年2月4日)71