よむ、つかう、まなぶ。
再生医療等の安全性の確保等に関する法律に基づく再生医療等に関連した「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」に基づく手続等について[582KB] (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
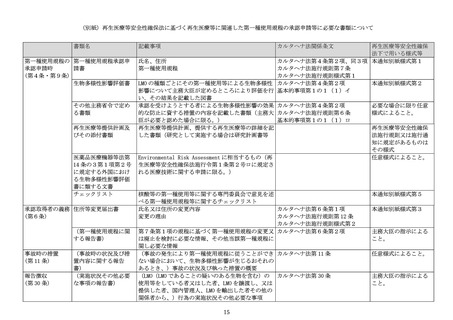
再生医療等安全性確保法の施行後1年間の移行期間を経て、同法に基づく再生医療等とし
て提供することが義務づけられる。指針に基づき実施している遺伝子治療臨床研究として、
既にカルタヘナ法の第一種使用規程の承認が得られている場合、その研究計画において、
承認済みの第一種使用規程の承認申請における申請書等の内容に新たな変更が加わらない
場合は、再生医療等安全性確保法に基づく再生医療等として提供を行う場合に、改めてカ
ルタヘナ法に基づく第一種使用規程の変更申請を行う必要はない。
(6) 再生医療等の安全性の確保等に関する法律施行令第1条第2号ロの規定に基づき感
染症の予防のために必要なものとして厚生労働大臣が定める核酸等の取扱い
再生医療等の安全性の確保等に関する法律施行令(平成 26 年政令第 278 号。以下「再生
医療等安全性確保法施行令」という。)第1条第2号ロの規定に基づき感染症の予防のた
めに必要なものとして厚生労働大臣が定める核酸等(以下「除外感染症医薬品」という。)
については、再生医療等技術から除外されるが、除外感染症医薬品を用いて臨床研究又は
医療として提供する場合にはカルタヘナ法の第一種使用等に該当する可能性があることに
留意すること。
なお、除外感染症医薬品に関する第一種使用規程について主務大臣の承認申請をしよう
とする場合は、2.(2)及び(3)の記載に準じて手続を行うこと。なお、この場合、
再生医療等提供計画に関する認定再生医療等委員会における審査のプロセスは要しないこ
とから、申請書等のうち再生医療等提供計画及びその添付書類については提出不要である。
一方で、当該除外感染症医薬品については、医薬品医療機器等法第 14 条の3第1項第2号
に規定する外国において製造販売承認がなされていることから、当該外国における除外感
染症医薬品の生物多様性又は環境への影響の評価に関する文書(例えば Environmental
Risk Assessment に相当するもの。
)を入手し申請書等の一部として提出すること。
3.第一種使用規程承認後における手続
カルタヘナ法第6条第1項に基づく変更事項の届出、同法第 11 条第1項に基づく事故の
状況及び執った措置の概要の届出等が必要な場合は、速やかに厚生労働省医政局研究開発
政策課あてに提出すること。その他、カルタヘナ法に基づき主務大臣から必要な情報の提
供等を求められた場合は、その指示等に従うこと。
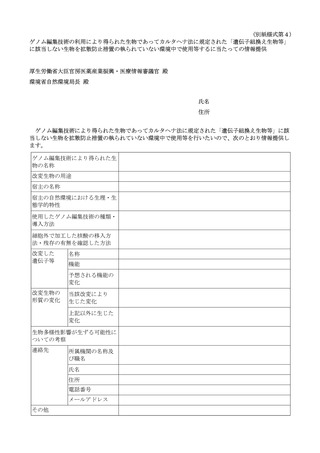
4.ゲノム編集技術の利用により得られた生物であってカルタヘナ法に規定された LMO に
該当しない生物を用いて再生医療等を提供しようとする場合の手続
「ゲノム編集技術の利用により得られた生物であってカルタヘナ法に規定された「遺伝
子組換え生物等」に該当しない生物の取扱いについて」(平成 31 年2月8日環自野発第
1902081 号環境省自然環境局長通知。以下「環境省通知」という。)において、ゲノム編集
技術の利用により得られた生物のうち、最終的に得られた生物に細胞外で加工した核酸
(ゲノム編集の標的とするゲノム配列に誘導するための核酸を含む。)が含まれていない
8
て提供することが義務づけられる。指針に基づき実施している遺伝子治療臨床研究として、
既にカルタヘナ法の第一種使用規程の承認が得られている場合、その研究計画において、
承認済みの第一種使用規程の承認申請における申請書等の内容に新たな変更が加わらない
場合は、再生医療等安全性確保法に基づく再生医療等として提供を行う場合に、改めてカ
ルタヘナ法に基づく第一種使用規程の変更申請を行う必要はない。
(6) 再生医療等の安全性の確保等に関する法律施行令第1条第2号ロの規定に基づき感
染症の予防のために必要なものとして厚生労働大臣が定める核酸等の取扱い
再生医療等の安全性の確保等に関する法律施行令(平成 26 年政令第 278 号。以下「再生
医療等安全性確保法施行令」という。)第1条第2号ロの規定に基づき感染症の予防のた
めに必要なものとして厚生労働大臣が定める核酸等(以下「除外感染症医薬品」という。)
については、再生医療等技術から除外されるが、除外感染症医薬品を用いて臨床研究又は
医療として提供する場合にはカルタヘナ法の第一種使用等に該当する可能性があることに
留意すること。
なお、除外感染症医薬品に関する第一種使用規程について主務大臣の承認申請をしよう
とする場合は、2.(2)及び(3)の記載に準じて手続を行うこと。なお、この場合、
再生医療等提供計画に関する認定再生医療等委員会における審査のプロセスは要しないこ
とから、申請書等のうち再生医療等提供計画及びその添付書類については提出不要である。
一方で、当該除外感染症医薬品については、医薬品医療機器等法第 14 条の3第1項第2号
に規定する外国において製造販売承認がなされていることから、当該外国における除外感
染症医薬品の生物多様性又は環境への影響の評価に関する文書(例えば Environmental
Risk Assessment に相当するもの。
)を入手し申請書等の一部として提出すること。
3.第一種使用規程承認後における手続
カルタヘナ法第6条第1項に基づく変更事項の届出、同法第 11 条第1項に基づく事故の
状況及び執った措置の概要の届出等が必要な場合は、速やかに厚生労働省医政局研究開発
政策課あてに提出すること。その他、カルタヘナ法に基づき主務大臣から必要な情報の提
供等を求められた場合は、その指示等に従うこと。
4.ゲノム編集技術の利用により得られた生物であってカルタヘナ法に規定された LMO に
該当しない生物を用いて再生医療等を提供しようとする場合の手続
「ゲノム編集技術の利用により得られた生物であってカルタヘナ法に規定された「遺伝
子組換え生物等」に該当しない生物の取扱いについて」(平成 31 年2月8日環自野発第
1902081 号環境省自然環境局長通知。以下「環境省通知」という。)において、ゲノム編集
技術の利用により得られた生物のうち、最終的に得られた生物に細胞外で加工した核酸
(ゲノム編集の標的とするゲノム配列に誘導するための核酸を含む。)が含まれていない
8