よむ、つかう、まなぶ。
再生医療等の安全性の確保等に関する法律に基づく再生医療等に関連した「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」に基づく手続等について[582KB] (26 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
備考
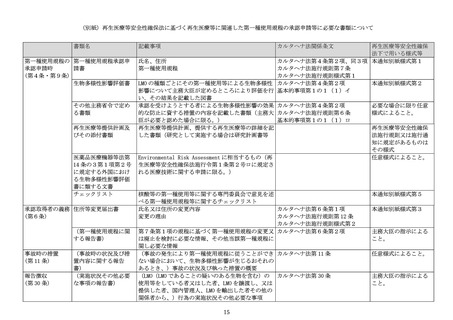
各項目の記載内容は以下によるものとする。なお、必要に応じて「別紙のとおり」と記載し、別紙を添付すること
で差し支えない。
1 「提出者」については、法人の場合は法人の名称及び代表者の氏名を記載し、主たる事務所の所在地を記載す
ること。
2 「ゲノム編集技術により得られた生物の名称」については、当該生物の宿主又は親生物の属する分類学上の種
の名称及び当該生物の特性等の情報を含めることにより、他の生物と明確に区別できる名称とすること。
3 「改変生物の用途」については、医薬品、医薬部外品、化粧品、医療機器、体外診断用医薬品又は再生医療等
製品のいずれに当たるかを記載し、当該生物の用途について概要を記載すること。
4 「宿主の名称」については、ゲノム編集技術により得られた生物の分類学上の名称を和名、英名及び学名を記
載すること。
5 「宿主の自然環境における生理・生態学的特性」については、培養可能な環境の条件、増殖の様式、有害物質
の産生性を簡潔に記載すること。
6 「使用したゲノム編集技術の種類・導入方法」については、当該生物の作成の過程で使用した人工ヌクレアー
ゼの種類(a. CRISPR/Cas9、b. TALEN、c. ZFN、d. その他(具体的に記載))を記載し、その移入方法(a. 人工ヌ
クレアーゼそのものを宿主の細胞内に移入、b. 人工ヌクレアーゼ遺伝子を組み込んだベクターを宿主の細胞内
に移入、c. 人工ヌクレアーゼ遺伝子を宿主のゲノムに挿入、d.その他(具体的に記載))を記載すること。
7 「細胞外で加工した核酸の移入方法・残存の有無を確認した方法」については、移入した核酸の構成、移入方
法、除去した方法及び残存の有無を確認した方法(a. PCR 法、b. サザンブロッティング法、c. その他(具体的
に記載))及びその解析結果について概要を記載し、具体的なデータを添付すること。
8 「改変した遺伝子等」については、
1)「名称」には、標的とした遺伝子等の名称を記載すること。
2)「機能」には、標的とした遺伝子等の発現により産生されるタンパク質等の機能を記載すること。
3)「予想される機能の変化」には、標的とした遺伝子等に改変をした場合に生ずると理論上考えられる機能の
変化について概要を記載すること。
9 「改変生物の形質の変化」については、
1)「当該改変により生じた変化」には、標的とした遺伝子の配列に対して生じた変化(a. 挿入、b.欠損、c.
置換)を記載し、当該改変により付与された生理・生態学的特性について宿主と比較し、特徴的な要点を記
載すること。
2)1)で記載したもの以外の変化が見られた場合は、「上記以外に生じた変化」にその内容を記載すること。
10 「生物多様性影響が生ずる可能性についての考察」については、当該生物を3のとおり使用等した場合に生物
多様性影響が生ずる可能性について、遺伝子組換え生物等の第一種使用等による生物多様性影響評価実施要領
(平成 15 年財務省・文部科学省・厚生労働省・農林水産省・経済産業省・環境省告示第2号)の別表第二に掲げ
る項目ごとに考察を簡潔に行い、それらを踏まえた総合的な考察を簡潔に記載すること。
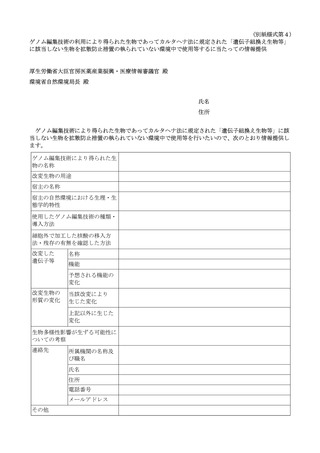
11 「連絡先」については、所属機関の名称及び職名、氏名、住所、電話番号、メールアドレスを記載すること。
12 「その他」については、厚生労働省医政局研究開発政策課への相談において、最終的に得られた生物に細胞外
で加工した核酸が含まれないことを確認している場合は、その旨を記載するとともに、当該相談の記録を別紙
として添付すること。また、研究段階等で主務官庁に情報提供を行っている場合は、その旨を記載するととも
に、当該情報提供の内容を別紙として添付すること。
13 当該別紙に記載されている(b)改変した生物の分類学上の種、(e)当該改変により付与された形質の変化、(g)当
該生物の用途、(h)当該生物を使用した場合に生物多様性影響が生ずる可能性に関する考察の概要及び主務官庁
名等ついては日本版バイオセーフティクリアリングハウス(J-BCH)のウェブサイトに掲載される予定である。
各項目の記載内容は以下によるものとする。なお、必要に応じて「別紙のとおり」と記載し、別紙を添付すること
で差し支えない。
1 「提出者」については、法人の場合は法人の名称及び代表者の氏名を記載し、主たる事務所の所在地を記載す
ること。
2 「ゲノム編集技術により得られた生物の名称」については、当該生物の宿主又は親生物の属する分類学上の種
の名称及び当該生物の特性等の情報を含めることにより、他の生物と明確に区別できる名称とすること。
3 「改変生物の用途」については、医薬品、医薬部外品、化粧品、医療機器、体外診断用医薬品又は再生医療等
製品のいずれに当たるかを記載し、当該生物の用途について概要を記載すること。
4 「宿主の名称」については、ゲノム編集技術により得られた生物の分類学上の名称を和名、英名及び学名を記
載すること。
5 「宿主の自然環境における生理・生態学的特性」については、培養可能な環境の条件、増殖の様式、有害物質
の産生性を簡潔に記載すること。
6 「使用したゲノム編集技術の種類・導入方法」については、当該生物の作成の過程で使用した人工ヌクレアー
ゼの種類(a. CRISPR/Cas9、b. TALEN、c. ZFN、d. その他(具体的に記載))を記載し、その移入方法(a. 人工ヌ
クレアーゼそのものを宿主の細胞内に移入、b. 人工ヌクレアーゼ遺伝子を組み込んだベクターを宿主の細胞内
に移入、c. 人工ヌクレアーゼ遺伝子を宿主のゲノムに挿入、d.その他(具体的に記載))を記載すること。
7 「細胞外で加工した核酸の移入方法・残存の有無を確認した方法」については、移入した核酸の構成、移入方
法、除去した方法及び残存の有無を確認した方法(a. PCR 法、b. サザンブロッティング法、c. その他(具体的
に記載))及びその解析結果について概要を記載し、具体的なデータを添付すること。
8 「改変した遺伝子等」については、
1)「名称」には、標的とした遺伝子等の名称を記載すること。
2)「機能」には、標的とした遺伝子等の発現により産生されるタンパク質等の機能を記載すること。
3)「予想される機能の変化」には、標的とした遺伝子等に改変をした場合に生ずると理論上考えられる機能の
変化について概要を記載すること。
9 「改変生物の形質の変化」については、
1)「当該改変により生じた変化」には、標的とした遺伝子の配列に対して生じた変化(a. 挿入、b.欠損、c.
置換)を記載し、当該改変により付与された生理・生態学的特性について宿主と比較し、特徴的な要点を記
載すること。
2)1)で記載したもの以外の変化が見られた場合は、「上記以外に生じた変化」にその内容を記載すること。
10 「生物多様性影響が生ずる可能性についての考察」については、当該生物を3のとおり使用等した場合に生物
多様性影響が生ずる可能性について、遺伝子組換え生物等の第一種使用等による生物多様性影響評価実施要領
(平成 15 年財務省・文部科学省・厚生労働省・農林水産省・経済産業省・環境省告示第2号)の別表第二に掲げ
る項目ごとに考察を簡潔に行い、それらを踏まえた総合的な考察を簡潔に記載すること。
11 「連絡先」については、所属機関の名称及び職名、氏名、住所、電話番号、メールアドレスを記載すること。
12 「その他」については、厚生労働省医政局研究開発政策課への相談において、最終的に得られた生物に細胞外
で加工した核酸が含まれないことを確認している場合は、その旨を記載するとともに、当該相談の記録を別紙
として添付すること。また、研究段階等で主務官庁に情報提供を行っている場合は、その旨を記載するととも
に、当該情報提供の内容を別紙として添付すること。
13 当該別紙に記載されている(b)改変した生物の分類学上の種、(e)当該改変により付与された形質の変化、(g)当
該生物の用途、(h)当該生物を使用した場合に生物多様性影響が生ずる可能性に関する考察の概要及び主務官庁
名等ついては日本版バイオセーフティクリアリングハウス(J-BCH)のウェブサイトに掲載される予定である。