よむ、つかう、まなぶ。
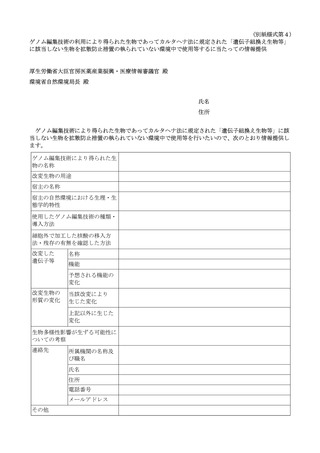
再生医療等の安全性の確保等に関する法律に基づく再生医療等に関連した「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」に基づく手続等について[582KB] (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
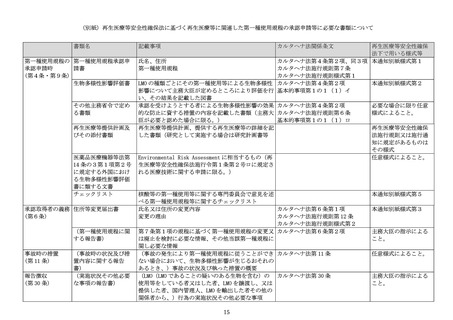
4) 記録の保管
第一種使用規程(第一種使用等の場所を限定する等生物多様性影響を防止するため
に第一種使用等の方法を限定する場合に限る。)の承認取得者は、使用等の態様、1)
の委員会等における検討結果等を記録し、保管するよう努めること。
(2) 再生医療等技術の第一種使用規程の承認申請について
再生医療等安全性確保法第2条第2項に規定する再生医療等技術については、個別の医
療技術として実施する場合、当該医療技術を用いる方法に応じた第一種使用等による生物
多様性への影響の評価を個別に行う必要がある。一方で、核酸等を用いる臨床研究を実施
しようとする場合であって、その目標として、医薬品、医療機器等の品質、有効性及び安
全性の確保等に関する法律(昭和 35 年法律第 145 号。以下「医薬品医療機器等法」とい
う。)の規定に基づき医薬品又は再生医療等製品としての製造販売承認を目指すときには、
一般流通を想定した評価が必要となる。
1)
将来、医薬品医療機器等法に基づき医薬品又は再生医療等製品としての製造販売承認
を目指す場合
再生医療等提供計画に係る特定認定再生医療等委員会における審査と並行して、「独
立行政法人医薬品医療機器総合機構が行う対面助言、証明確認調査等の実施要綱等につ
いて」
(平成 24 年3月2日付け薬機発第 0302070 号。最終改正令和7年5月8日又はそ
の最新版。
)の別添 31 に基づき、医薬品医療機器総合機構(以下「PMDA」という。)にお
ける第一種使用規程承認申請に係る事前審査前相談を受け、PMDA に薬事開発及び製造販
売承認申請を目指した第一種使用規程承認申請を行うこと。
また、2) 個別の医療技術として実施する場合の手続により第一種使用規程の承認申請
をし、主務大臣による承認を受けた後、改めて医薬品又は再生医療等製品としての製造
販売承認を目指す場合には、第一種使用規程の更新の必要性について PMDA に相談するこ
と。
2)
個別の医療技術として実施する場合
再生医療等安全性確保法に基づき、再生医療等技術として提供することを目的とする
場合(前 1)に掲げる場合を除く。
)は、個別の再生医療等提供計画について第一種使用
規程の評価を行うことが必要である。核酸等を用いる再生医療等は第一種再生医療等に
該当するため、その提供にあたっては、部会での再生医療等提供基準への適合性の確認
が行われる。臨床研究として実施する場合は、特定認定再生医療等委員会における適合
性の確認と並行してカルタヘナ法の第一種使用規程の承認申請を開始して差し支えない。
臨床研究以外で核酸等を用いる再生医療等を提供しようとする場合は、既に有効性が確
4
第一種使用規程(第一種使用等の場所を限定する等生物多様性影響を防止するため
に第一種使用等の方法を限定する場合に限る。)の承認取得者は、使用等の態様、1)
の委員会等における検討結果等を記録し、保管するよう努めること。
(2) 再生医療等技術の第一種使用規程の承認申請について
再生医療等安全性確保法第2条第2項に規定する再生医療等技術については、個別の医
療技術として実施する場合、当該医療技術を用いる方法に応じた第一種使用等による生物
多様性への影響の評価を個別に行う必要がある。一方で、核酸等を用いる臨床研究を実施
しようとする場合であって、その目標として、医薬品、医療機器等の品質、有効性及び安
全性の確保等に関する法律(昭和 35 年法律第 145 号。以下「医薬品医療機器等法」とい
う。)の規定に基づき医薬品又は再生医療等製品としての製造販売承認を目指すときには、
一般流通を想定した評価が必要となる。
1)
将来、医薬品医療機器等法に基づき医薬品又は再生医療等製品としての製造販売承認
を目指す場合
再生医療等提供計画に係る特定認定再生医療等委員会における審査と並行して、「独
立行政法人医薬品医療機器総合機構が行う対面助言、証明確認調査等の実施要綱等につ
いて」
(平成 24 年3月2日付け薬機発第 0302070 号。最終改正令和7年5月8日又はそ
の最新版。
)の別添 31 に基づき、医薬品医療機器総合機構(以下「PMDA」という。)にお
ける第一種使用規程承認申請に係る事前審査前相談を受け、PMDA に薬事開発及び製造販
売承認申請を目指した第一種使用規程承認申請を行うこと。
また、2) 個別の医療技術として実施する場合の手続により第一種使用規程の承認申請
をし、主務大臣による承認を受けた後、改めて医薬品又は再生医療等製品としての製造
販売承認を目指す場合には、第一種使用規程の更新の必要性について PMDA に相談するこ
と。
2)
個別の医療技術として実施する場合
再生医療等安全性確保法に基づき、再生医療等技術として提供することを目的とする
場合(前 1)に掲げる場合を除く。
)は、個別の再生医療等提供計画について第一種使用
規程の評価を行うことが必要である。核酸等を用いる再生医療等は第一種再生医療等に
該当するため、その提供にあたっては、部会での再生医療等提供基準への適合性の確認
が行われる。臨床研究として実施する場合は、特定認定再生医療等委員会における適合
性の確認と並行してカルタヘナ法の第一種使用規程の承認申請を開始して差し支えない。
臨床研究以外で核酸等を用いる再生医療等を提供しようとする場合は、既に有効性が確
4