よむ、つかう、まなぶ。
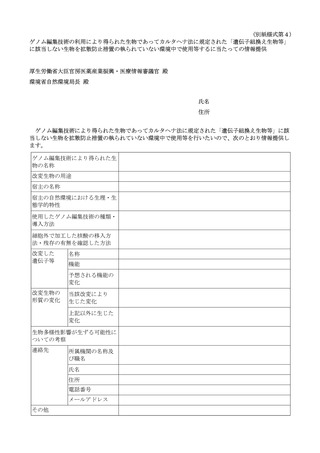
再生医療等の安全性の確保等に関する法律に基づく再生医療等に関連した「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」に基づく手続等について[582KB] (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
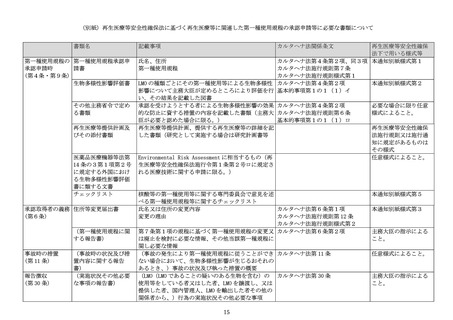
3遺伝子組換え生物等の調製方法
(1) 宿主内に移入された核酸全体の構成
(2) 宿主内に移入された核酸の移入方法
(3)遺伝子組換え生物等の育成の経過
Ⅱ章3(1)には、LMO のゲノムの全体における供与核酸を含め、全ての構成要素の位置を示すこと。その際には、塩
基配列上、各構成要素がどこからどこまでか分かるよう示すこと。ゲノムサイズが非常に大きなウイルスの場合や、反
復配列が多い場合等で全塩基配列の決定が困難なウイルスの場合には、部分的に宿主の文献情報を利用して説明するは
差し支えない。
Ⅱ章3(2)には、LMO の調製にプラスミドを使用する場合は、その概要を示すこと。遺伝子組換えウイルスの調製に
パッケージング細胞等が必要であれば、その細胞の由来と特性を示すこと。当該プラスミド、細胞株等を用いて遺伝子
組換えウイルスを調製する方法を記載すること。
Ⅱ章3(3)には、実施される構築された LMO から、再生医療等を受ける者に投与される最終産物に至るまでの製造工
程の概要(製造場所(国内/海外の別)の記載を含む。)を記載すること。具体的な製造方法は、概略図(フローチャ
ート)等を用いて別紙に記載すること。LMO が非増殖性の遺伝子組換えウイルスの場合、増殖可能なウイルスが検出さ
れないこと並びに検出方法及び検出限界を記載すること。詳細な品質管理方法は別紙に記載すること。
4移入した核酸の存在状態及び当該核酸による形質発現の安定性
Ⅱ章4には、宿主に移入された核酸の存在状態を記載すること。特別な性質が認められないのであれば、
「移入された
核酸は、遺伝子組換え生物等のゲノムの一部として存在する。
」等のように記載すること。LMO 又は LMO のゲノムが標的
細胞内に留まる場合には、その存在位置と形態(染色体に挿入されたプロウイルス、エピソーム等)
、安定性(持続
性)及び供与核酸の発現の持続性について記載すること。体外遺伝子導入に用いる場合は、標的細胞への感染方法を記
載すること。
5遺伝子組換え生物等の検出及び識別の方法並びにそれらの感度及び信頼性
<非臨床試験>
<臨床試験>
非臨床試験の項には、動態及び生体内分布試験で実施した遺伝子組換えウイルスの検出方法及び感度(検出限界、定量
下限等)を記載し、詳細な試験方法は別紙に記載すること。
臨床試験の項には、臨床研究又は臨床試験が実施されている場合に、当該研究又は試験における宿主及び LMO を識別す
る方法を記載すること。採取検体、検出方法、検出方法の妥当性について概略を記載すること。詳細は別紙に記載する
こと。臨床試験において、核酸増幅法を用いる場合であって非臨床試験と同じプライマー-プローブセットを使用する
場合は、その旨を記載すること。また、用いる検査系について動物のデータしかない場合でも、それらのデータを用い
て人の検体の測定が行える系であることを説明すること。
6宿主又は宿主の属する分類学上の種との相違
Ⅱ章6には、宿主又は宿主の属する分類学上の種と LMO の構成要素や特性の相違点、生存能、増殖能、感染能、感染宿
主等に関して記載すること。宿主から除去された構成要素がある場合には、当該構成要素の機能及び当該構成要素を除
去することによる LMO の特性の変化についても記載すること。別紙引用としても差し支えない。
(1) 宿主内に移入された核酸全体の構成
(2) 宿主内に移入された核酸の移入方法
(3)遺伝子組換え生物等の育成の経過
Ⅱ章3(1)には、LMO のゲノムの全体における供与核酸を含め、全ての構成要素の位置を示すこと。その際には、塩
基配列上、各構成要素がどこからどこまでか分かるよう示すこと。ゲノムサイズが非常に大きなウイルスの場合や、反
復配列が多い場合等で全塩基配列の決定が困難なウイルスの場合には、部分的に宿主の文献情報を利用して説明するは
差し支えない。
Ⅱ章3(2)には、LMO の調製にプラスミドを使用する場合は、その概要を示すこと。遺伝子組換えウイルスの調製に
パッケージング細胞等が必要であれば、その細胞の由来と特性を示すこと。当該プラスミド、細胞株等を用いて遺伝子
組換えウイルスを調製する方法を記載すること。
Ⅱ章3(3)には、実施される構築された LMO から、再生医療等を受ける者に投与される最終産物に至るまでの製造工
程の概要(製造場所(国内/海外の別)の記載を含む。)を記載すること。具体的な製造方法は、概略図(フローチャ
ート)等を用いて別紙に記載すること。LMO が非増殖性の遺伝子組換えウイルスの場合、増殖可能なウイルスが検出さ
れないこと並びに検出方法及び検出限界を記載すること。詳細な品質管理方法は別紙に記載すること。
4移入した核酸の存在状態及び当該核酸による形質発現の安定性
Ⅱ章4には、宿主に移入された核酸の存在状態を記載すること。特別な性質が認められないのであれば、
「移入された
核酸は、遺伝子組換え生物等のゲノムの一部として存在する。
」等のように記載すること。LMO 又は LMO のゲノムが標的
細胞内に留まる場合には、その存在位置と形態(染色体に挿入されたプロウイルス、エピソーム等)
、安定性(持続
性)及び供与核酸の発現の持続性について記載すること。体外遺伝子導入に用いる場合は、標的細胞への感染方法を記
載すること。
5遺伝子組換え生物等の検出及び識別の方法並びにそれらの感度及び信頼性
<非臨床試験>
<臨床試験>
非臨床試験の項には、動態及び生体内分布試験で実施した遺伝子組換えウイルスの検出方法及び感度(検出限界、定量
下限等)を記載し、詳細な試験方法は別紙に記載すること。
臨床試験の項には、臨床研究又は臨床試験が実施されている場合に、当該研究又は試験における宿主及び LMO を識別す
る方法を記載すること。採取検体、検出方法、検出方法の妥当性について概略を記載すること。詳細は別紙に記載する
こと。臨床試験において、核酸増幅法を用いる場合であって非臨床試験と同じプライマー-プローブセットを使用する
場合は、その旨を記載すること。また、用いる検査系について動物のデータしかない場合でも、それらのデータを用い
て人の検体の測定が行える系であることを説明すること。
6宿主又は宿主の属する分類学上の種との相違
Ⅱ章6には、宿主又は宿主の属する分類学上の種と LMO の構成要素や特性の相違点、生存能、増殖能、感染能、感染宿
主等に関して記載すること。宿主から除去された構成要素がある場合には、当該構成要素の機能及び当該構成要素を除
去することによる LMO の特性の変化についても記載すること。別紙引用としても差し支えない。