よむ、つかう、まなぶ。
再生医療等の安全性の確保等に関する法律に基づく再生医療等に関連した「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」に基づく手続等について[582KB] (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
生性、核酸を水平伝達する性質、その他の性質)ごとに個別に記載した上で、それらを踏まえた総合的な判断の結果を
記載すること。説明した上で、総合的判断を記載すること。
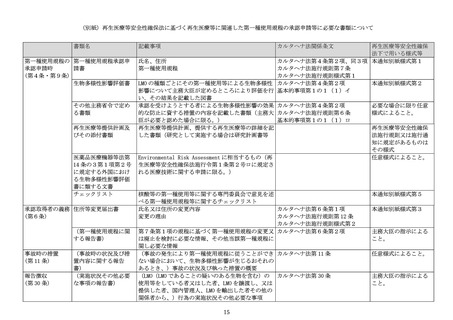
生物多様性影響評価書別紙一覧
別紙1:本遺伝子組換え生物等の情報(構成要素のゲノム上の位置・由来・機能等、本遺伝子組換え
生物等のゲノムの全塩基配列、アミノ酸配列(供与核酸に由来する、又は供与核酸と結合したタンパ
ク質のアミノ酸配列に加え、エンベロープ、キャプシド等を宿主以外から供給している場合はそのア
ミノ酸配列)
、相同性検索・ORF 検索結果等)
別紙2:LMO の製造方法(フロー図による概要等でも可)及び RCV の管理状況
別紙3:LMO の検出試験(試験方法、定量限界・検出限界))
別紙4:非臨床生体内分布試験結果概要
別紙5:臨床試験結果概要(分布・排出)
※ 別紙の構成は申請者により適宜変更して差し支えない。
※ 別紙の本文は原則日本語とすること。ただし、図表等に英語が含まれることは差し支えない。
※ 必要な情報が含まれていれば、提供する再生医療等の詳細を記した文書(研究の場合は、研究計画
書)又はその他の再生医療等提供計画の添付書類を抜粋して差し支えない。
※ 再生医療等安全性確保法施行令第1条第2号ロの規定に基づき感染症の予防のために必要なものと
して厚生労働大臣が定める核酸等について本評価書を用いる場合は、欧州の治験の開始等にあたって
当局へ提出する Environment Risk Assessment(ERA)の情報を別紙として添付すること。
備考
1
2
3
各記入欄の大きさは、文字数に応じて適宜調整すること。
「記載に際しての留意事項」を本様式中に示しているので記載に当たっては留意すること。但し、これ
ら留意事項は、遺伝子組換えウイルスを LMO として使用等することを念頭に記載しているものであるこ
とから、その他の場合は、本留意事項の記載を参考に、個別の技術に応じて適切に判断すること。
用紙の大きさは、日本産業規格A4とすること。
記載すること。説明した上で、総合的判断を記載すること。
生物多様性影響評価書別紙一覧
別紙1:本遺伝子組換え生物等の情報(構成要素のゲノム上の位置・由来・機能等、本遺伝子組換え
生物等のゲノムの全塩基配列、アミノ酸配列(供与核酸に由来する、又は供与核酸と結合したタンパ
ク質のアミノ酸配列に加え、エンベロープ、キャプシド等を宿主以外から供給している場合はそのア
ミノ酸配列)
、相同性検索・ORF 検索結果等)
別紙2:LMO の製造方法(フロー図による概要等でも可)及び RCV の管理状況
別紙3:LMO の検出試験(試験方法、定量限界・検出限界))
別紙4:非臨床生体内分布試験結果概要
別紙5:臨床試験結果概要(分布・排出)
※ 別紙の構成は申請者により適宜変更して差し支えない。
※ 別紙の本文は原則日本語とすること。ただし、図表等に英語が含まれることは差し支えない。
※ 必要な情報が含まれていれば、提供する再生医療等の詳細を記した文書(研究の場合は、研究計画
書)又はその他の再生医療等提供計画の添付書類を抜粋して差し支えない。
※ 再生医療等安全性確保法施行令第1条第2号ロの規定に基づき感染症の予防のために必要なものと
して厚生労働大臣が定める核酸等について本評価書を用いる場合は、欧州の治験の開始等にあたって
当局へ提出する Environment Risk Assessment(ERA)の情報を別紙として添付すること。
備考
1
2
3
各記入欄の大きさは、文字数に応じて適宜調整すること。
「記載に際しての留意事項」を本様式中に示しているので記載に当たっては留意すること。但し、これ
ら留意事項は、遺伝子組換えウイルスを LMO として使用等することを念頭に記載しているものであるこ
とから、その他の場合は、本留意事項の記載を参考に、個別の技術に応じて適切に判断すること。
用紙の大きさは、日本産業規格A4とすること。