よむ、つかう、まなぶ。
再生医療等の安全性の確保等に関する法律に基づく再生医療等に関連した「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」に基づく手続等について[582KB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
医政研発 0530 第1号
令和7年5月 30 日
都 道 府 県
各
保健所設置市
特
別
衛生主管部(局)長 殿
区
厚生労働省医政局研究開発政策課長
(
公
印
省
略
)
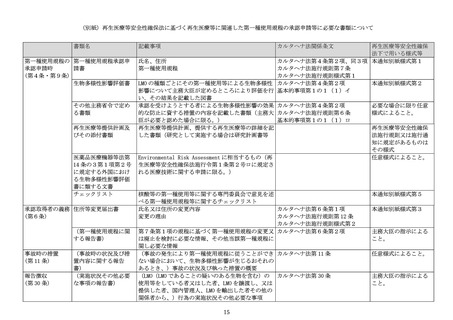
再生医療等の安全性の確保等に関する法律に基づく再生医療等に関連した
「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」
に基づく手続等について
平素より厚生労働行政に御協力いただき厚く御礼申し上げます。
「遺伝子治療等臨床研究に関する指針」
(平成 31 年厚生労働省告示第 48 号。以下「指
針」という。)に関連した遺伝子組換え生物等の使用等の規制による生物の多様性の確保
に関する法律(平成 15 年法律第 97 号。以下「カルタヘナ法」という。
)の規定に基づく遺
伝子組換え生物等(以下「LMO」という。)の第一種使用規程の承認申請については、「遺
伝子治療臨床研究に関する「遺伝子組換え生物等の使用等の規制による生物の多様性の確
保に関する法律」に基づく第一種使用規程承認申請の手続等について」(平成 16 年2月 19
日付け科発第 0219001 号厚生労働省大臣官房厚生科学課長通知。以下「指針通知」という。
)
に基づき実施されてきたところです。
再生医療等の安全性の確保等に関する法律及び臨床研究法の一部を改正する法律(令和
6年法律第 51 号。以下「改正法」という。)が令和7年5月 31 日に施行されるにあた
り、核酸等を用いる医療技術に係る再生医療等については、再生医療等の安全性の確保等
に関する法律(平成 25 年法律第 85 号。以下「再生医療等安全性確保法」という。
)の対
象となります。再生医療等安全性確保法の規定に基づく再生医療等の提供に関連し、カル
タヘナ法における第一種使用等に該当する場合の承認申請等の手続について、下記のとお
り必要な事項を定めたため、御了知の上、関係者に対する周知をお願いいたします。な
お、本通知の内容について、公益社団法人日本医師会、公益社団法人日本歯科医師会、認
定再生医療等委員会設置者、特定細胞加工物製造事業者及びその他関係団体等に対しても
別途周知を行っている旨申し添えます。
なお、本通知は改正法の施行の日(令和7年5月 31 日)から適用することとし、指針
通知については「
「再生医療等の安全性の確保等に関する法律及び臨床研究法の一部を改
正する法律」の施行に伴う「遺伝子治療等臨床研究に関する指針」等の取扱いについて」
1
令和7年5月 30 日
都 道 府 県
各
保健所設置市
特
別
衛生主管部(局)長 殿
区
厚生労働省医政局研究開発政策課長
(
公
印
省
略
)
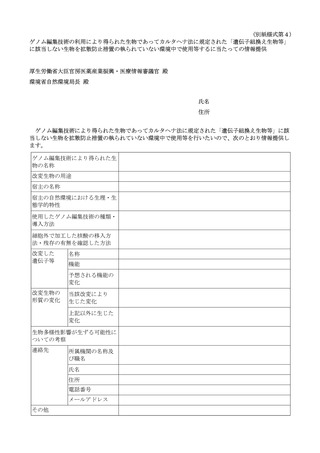
再生医療等の安全性の確保等に関する法律に基づく再生医療等に関連した
「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」
に基づく手続等について
平素より厚生労働行政に御協力いただき厚く御礼申し上げます。
「遺伝子治療等臨床研究に関する指針」
(平成 31 年厚生労働省告示第 48 号。以下「指
針」という。)に関連した遺伝子組換え生物等の使用等の規制による生物の多様性の確保
に関する法律(平成 15 年法律第 97 号。以下「カルタヘナ法」という。
)の規定に基づく遺
伝子組換え生物等(以下「LMO」という。)の第一種使用規程の承認申請については、「遺
伝子治療臨床研究に関する「遺伝子組換え生物等の使用等の規制による生物の多様性の確
保に関する法律」に基づく第一種使用規程承認申請の手続等について」(平成 16 年2月 19
日付け科発第 0219001 号厚生労働省大臣官房厚生科学課長通知。以下「指針通知」という。
)
に基づき実施されてきたところです。
再生医療等の安全性の確保等に関する法律及び臨床研究法の一部を改正する法律(令和
6年法律第 51 号。以下「改正法」という。)が令和7年5月 31 日に施行されるにあた
り、核酸等を用いる医療技術に係る再生医療等については、再生医療等の安全性の確保等
に関する法律(平成 25 年法律第 85 号。以下「再生医療等安全性確保法」という。
)の対
象となります。再生医療等安全性確保法の規定に基づく再生医療等の提供に関連し、カル
タヘナ法における第一種使用等に該当する場合の承認申請等の手続について、下記のとお
り必要な事項を定めたため、御了知の上、関係者に対する周知をお願いいたします。な
お、本通知の内容について、公益社団法人日本医師会、公益社団法人日本歯科医師会、認
定再生医療等委員会設置者、特定細胞加工物製造事業者及びその他関係団体等に対しても
別途周知を行っている旨申し添えます。
なお、本通知は改正法の施行の日(令和7年5月 31 日)から適用することとし、指針
通知については「
「再生医療等の安全性の確保等に関する法律及び臨床研究法の一部を改
正する法律」の施行に伴う「遺伝子治療等臨床研究に関する指針」等の取扱いについて」
1